DIPG是什么?弥漫性内生型桥脑胶质瘤是一种致死率极高却又缺乏有效治疗手段的儿童恶性脑肿瘤,典型的临床表现和特异性的影像学特点可以诊断为DIPG,影像学不典型的病例建议行活检手术明确诊断!不幸的是,目前DIPG的治疗选择非常有限。肿瘤不能通过手术切除,因为肿瘤细胞都与脑干中的正常细胞混合在一起,而这些细胞对呼吸等功能至关重要。常规治疗手段中仅有放疗具有一定疗效,可以改善患儿症状,但是即使是放射治疗也不能使肿瘤永久消失。迄今为止,无论是传统细胞毒药物,还是替莫唑胺、贝伐珠单抗等多种化疗方案均未能改善DIPGs的预后。研究人员已经尝试了许多治疗DIPG的化学疗法,但是到目前为止,没有一种非常有效。5年存活率低于1%,中位生存期为9个月!
就在一周前(8月7日),美国食品药品管理局(FDA)授予paxalisib罕见儿科疾病资格(RPDD),用于治疗弥漫性内生型桥脑胶质瘤(Diffuse intrinsic pontine glioma.DIPG),一种罕见且高度侵袭性的儿童脑癌。这是一种能穿过血脑屏障的PI3K/AKT/mTOR通路小分子抑制剂,于2018年进入II期临床试验。在2018年2月,FDA还授予了paxalisib治疗胶质母细胞瘤的孤儿药资格(ODD),这是非常常见和较具侵袭性的原发性脑癌。
RPDD代表着什么?是否就意味着该药已经被正式批准。事实上RPDD指的是可被授予那些用于治疗主要影响美国儿童(18岁以下)、每年新发病率低于20万例、严重或危及生命疾病的在研药物。RPDD计划旨在通过对工业界的激励,促进某些严重和危及生命的罕见儿科疾病的药物和生物制剂的开发。在这项激励措施中,较重要的是,在研药物在获得针对这种罕见儿科疾病的新药批准时,FDA将颁发给开发商一张优先审查凭证(PRV)。由于被授予了RPDD,如果paxalisib被批准用于治疗DIPG,Kazia公司将有资格获得一张“罕见儿科疾病优先审查凭证(PRV)”。PRV持有人可要求对提交给FDA的新药申请进行为期6个月的快速审查(常规审查期为12个月)。简单来说就是该药还是处于研发阶段,尚未正式临床应用。目前paxalisib治疗DIPG已获得了临床前阳性数据,初步临床疗效数据预计2020财年下半年获得。如果获得阳性结果,将大大提高未来获得FDA颁发PRV的机会。
Kazia公司首席执行官James Garner博士表示:“虽然胶质母细胞瘤仍然是paxalisib的主要关注点,但我们也一直在致力于开发paxalisib治疗儿童脑癌。对于诊断为DIPG的患者,目前还没有FDA批准的药物疗法,从确诊后的平均存活期约为9.5个月。FDA授予RPDD,肯定了我们迄今为止所做的努力和取得的成就,使我们能够更好地推动paxalisib作为DIPG潜在治疗方法,并致力于了解paxalisib是否能够帮助治疗这一极具挑战性的儿科疾病。”
其实在今年4月初,Kazia公司已经公布了正在进行的评估paxalisib治疗多形性胶质母细胞瘤(GBM)II期研究(NCT03522298)的阳性中期数据。该研究在新诊断的、非甲基化MGMT启动子状态的GBM患者中开展,正在评估患者接受较大限度手术切除和替莫唑胺(temozolomide,TMZ)联合同步放化疗后,将paxalisib作为辅助治疗药物的安全性、耐受性、推荐的II期剂量(RP2D)、药代动力学(PK)和临床活性。TMZ是目前治疗GBM的标准护理疗法。
paxalisib与替莫唑胺(现有护理标准)比较的数据汇总表
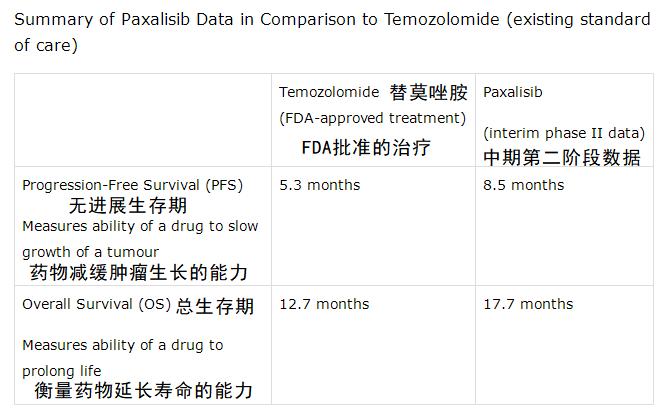
研究数据要点:(1)paxalisib辅助治疗的中位总生存期(OS)为17.7个月,与现有标准护理TMZ相关的12.7个月相比,代表着临床意义的生命延长。(2)paxalisib辅助治疗的中位无进展生存期(PFS)为8.5个月,与现有标准护理TMZ相关的5.3个月相比,代表着有利结果。(3)接受治疗时间较长的患者,在确诊后19个月仍保持疾病无进展。(4)大约一半的入组患者,仍然在接受paxalisib治疗,随着研究的继续推进,OS和PFS数据可能进一步改善。
Kazia首席执行官表示:对于任何新的抗癌药物而言,“金标准”都是延长生命的能力——在胶质母细胞瘤(GBM)等疾病中,这是一个特别具有挑战性的目标。这些新数据提供了第一份临床证据,证明paxalisib有潜力在一个非常具有挑战性的患者群体中实现这一目标。二十多年来,对于新诊断的胶质母细胞瘤患者没有任何新的药物治疗,我们渴望改变这种状况。我们相信,paxalisib正迅速成为治疗这一极具挑战性疾病的全球渠道中较有希望的候选药物之一,我们将努力使患者尽快、高效地获得这一药物。这项研究将继续跟踪一些仍在接受治疗的患者,该研究的进一步数据预计将在2020财年下半年公布,较终数据预计将在2021财年上半年公布。
作为一名神经外科医生还是衷心希望该药物确实能够切实改善DIPG患者的预后,早日进入临床应用。因为见过太多的孩子得了这个绝症而无有效治疗手段,只能等待死神的宣判。无论是患儿,还是患儿家属,真的都太让人心疼,太多的无奈与惋惜。
数据来源:1、US FDA Grants Rare Pediatric Disease Designation (RPDD) to Paxalisib for DIPG
2、https://seekingalpha.com/pr/17830236-kazias-paxalisib-shows-positive-overall-survival-signal-in-phase-ii-glioblastoma-study



 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号
