脑桥脑干肿瘤是目前国际的医学难题,恶化进展快、预后差,病因、治疗的研究目前还很有限,哪些因素提示预后不良?目前的研究手术、放疗、化疗作用多大?都有哪些前沿疗法?磁共振引导聚焦超声如何作用?对流增强递送 (CED) 靶向增强放射免疫疗法有无效果?同种异体肿瘤细胞系裂解物治疗效果怎样等?看看国际这类患者都有怎样的理想治疗治疗?一文带您详细了解INC国际神外教授Rutka在脑桥肿瘤的研究论著。
脑干肿瘤是跨越脑干中脑、脑桥、延髓区域并可压迫小脑、颈髓等的一组异质性肿瘤,脑干肿瘤占儿童颅内肿瘤的10%-20%,占成人颅内肿瘤的1.5%~2.5%,脑干胶质瘤是较常见的病理类型,其他包括海绵状血管瘤、转移瘤、成血管细胞瘤、淋巴瘤等。
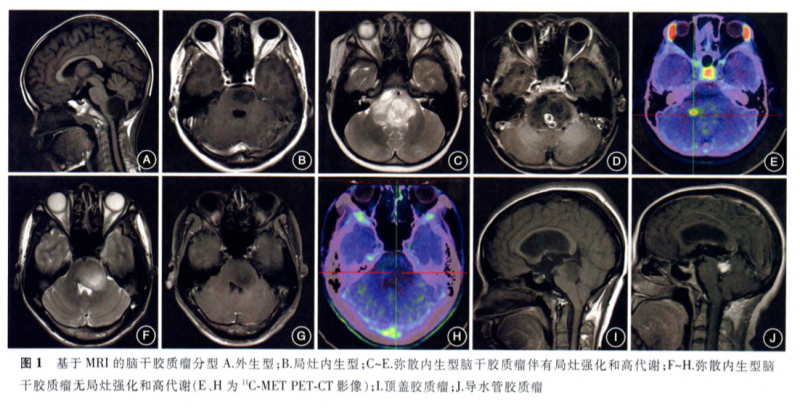
图1. 基于MRI的脑干胶质瘤分型 A.外生型;B.局灶内生型;C-E.弥散内生型脑干胶质瘤伴有局灶强化和高代谢;F-H.弥散内生型脑干胶质瘤无局灶强化和高代谢(C、H为11C-METPET-CT影像);I.顶盖胶质瘤;J.导水管胶质瘤.不同型治疗或预后会有差别
INC国际神经外科顾问团成员、加拿大SickKids儿童医院脑瘤研究中心主任、国际神经外科学院前主席、国际神经外科杂志《Journal of Neurosurgery》主编James T. Rutka教授在其发表于Springer Nature Switzerland AG 2019上的《Brainstem Tumors in Children》文章中详细阐述了中脑肿瘤、脑桥肿瘤、延髓肿瘤等不同类型儿童脑干肿瘤的临床症状、诊断方法、分型、治疗办法及预后等,可为国内外的小儿脑干肿瘤患者治疗提供国际标准的参考。本文则介绍脑干脑桥区域多发的儿童瘤种及相关的治疗解读。
脑桥肿瘤:儿童脑桥肿瘤通常是恶性程度不同的胶质瘤,主要分为弥漫性内生性脑桥胶质瘤(DIPG)、背侧外生或局灶性脑桥肿瘤,主要基于神经放射学表现。在这里,我们将主要介绍 DIPG 和背侧外生性脑桥胶质瘤。
1、弥漫性内生性脑桥胶质瘤(DIPG)
弥漫性内生性脑桥胶质瘤(DIPG)约占全部脑干肿瘤的 70%,使其成为较常见的脑干瘤种。通常,这些病变是高级别肿瘤,尽管进行了各种治疗,但大多数儿童在诊断后 2 年内死亡,总体生存率低。DIPG的性别发病率相等,大多数儿童在诊断时年龄在5至10岁之间。是重要的是,儿童 DIPG 的分子遗传学现在了进一步的研究发现得到,新的基因遗传途径被发现为该肿瘤发生的驱动因素,包括 ACVR1、H3K27M、PDGB 和其他(图 20.7)

分子遗传特征示意图DIPGs。 DIPG 的主要遗传驱动因素包括MYCN、ACVR1、H3K27M、PDGFRA 和 PAX3,其中其他(改编自 Misuraca、Cordero 和Becher, Front Oncol 2015)
临床症状
通常会迅速出现相关的临床症状,包括颅神经功能缺损(例如,面部神经麻痹、6颅神经麻痹引起复视)、锥体束征和共济失调。脑积水可能导致头痛和颅内压增高综合征,但这通常是疾病过程中的晚期表现。
诊断方法
DIPG的诊断常常通过MRI进行。通常,脑桥弥性扩大,占脑干该区域的 50-75% 或更多。可能有外生成分,是腹侧。增强后可能会有强化,但通常是斑片状的,合并脑桥弥漫性肿胀。有时,基底动脉可能完全被肿瘤覆盖(图 20.8)。其他 MR序列和技术已用于DIPG,包括显示较低的平均总胆碱浓度的磁共振波谱成像 (MRS)和弥散张量成像 (DTI) ,但这些在评估病变的神经病理学特点以及结局方面并未被证明是可靠的。
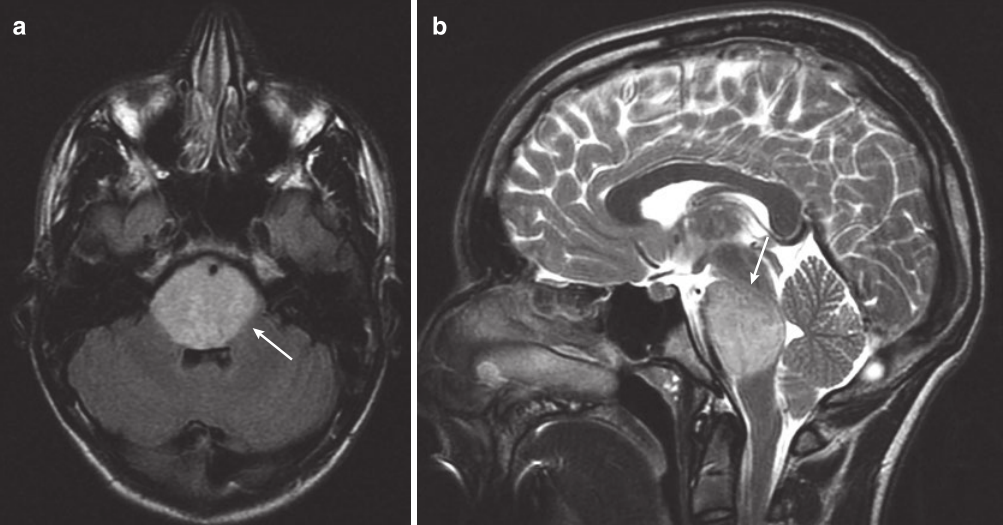
图20.8 一名 14 岁男孩的 MRI 扫描,他有短暂的复视、共济失调和左侧面瘫。 (a) 轴向FLAIR MRI 显示高信号占据整个脑桥(箭头)。 (b) 矢状 T2 MRI 显示DIPG使脑桥范围受累(箭头)
临床分类
对于患有 DIPG 的儿童,临床没有一致的疾病分期标准。随着疾病的进展,可能会通过软脑膜播种转移到大脑的其他区域或脊髓轴。
治疗方法
对于多数患有 DIPG 的儿童,直接手术可能没有作用。
此外,多年来,通常的做法是不对 MRI 可以明确肿瘤为典型DIPG的儿童进行病理活检手术,避免额外的神经损伤。影像 MRI 明确诊断为 DIPG 的儿童建议及时进行放射治疗,包括使用 IMRT 调强放疗或超分割放射治疗。 现在已经进行了许多临床试验来评估化疗在 DIPG 中的作用。化疗药物如长春新碱,洛莫司汀,泼尼松,顺铂,环磷酰胺,依托泊苷和他莫昔芬都已尝试过,但效果不佳。
认识到某些 DIPG 可能具有非典型特征(例如,10 岁以上的儿童,脑干受累率低于 50% 的横向增强肿瘤),一些中心现在为这些患者提供立体定向活检。立体定向活检可以顺利地进行,并可以对新鲜肿瘤标本进行分子遗传学的群体中,有合理的期望发现新的或可靶向的遗传病变。现在正在对患有 DIPG 的儿童进行一些创新的临床试验。Souweidane及其同事较近发表了他们关于使用对流增强递送 (CED) 靶向神经胶质瘤相关 B7-H3 抗原的放射免疫疗法药物以及许多其他靶向药物治疗患有 DIPG 的儿童的发现。他们已经表明,在已经接受过放射治疗的儿童中使用 CED 既顺利又可能合适。此外,较近对免疫疗法进行了更进一步的研究。 Benitez-Ribas 等人使用同种异体肿瘤细胞系裂解物脉冲的自体树突状细胞治疗患有 DIPG 的儿童。他们表明,该协议会导致明确的免疫反应,并可能成为未来治疗的有希望的支柱。我们较近表明,在实验模型中,使用磁共振引导聚焦超声 (MRgFUS) 可以增加化疗药物(特别是阿霉素)向脑干的输送。
预后及生存质量
尽管进行了强化治疗,但患有 DIPG 的儿童的预后仍然很差。DIPG 仍然存在高度的化疗和放疗抵抗性。儿童在完成放射治疗后通常会保持缓解6-8 个月。 然而,有一些预兆预后不良,包括诊断时年龄小于 2 岁、多颅神经麻痹,以及诊断前症状迅速发作。 有时,只有通过持续使用皮质类固醇才能提高生活质量; 然而,这些应该受到限制,以便儿童不会遭受这些药物的一些可怕的副作用。 在提供全部形式的治疗且均失败后,应在肿瘤明显进展时提供姑息治疗。
2、背侧外生性脑桥胶质瘤
症状和临床体征
背侧外生性脑桥胶质瘤约占儿童脑干胶质瘤的20%。它们往往隐匿起病,患者在 6-12 个月的时间段内报告轻微的症状。一些典型症状包括头痛和呕吐;共济失调、外展或面神经麻痹和斜颈是一些典型的神经系统症状。
诊断方法
CT扫描仍可用作快速筛查工具。在 CT 上,这些病变通常是低密度的并充满四脑室。明亮的强化也可能很明显(图 20.9)。MRI已成为用于背侧外生性脑干胶质瘤儿童的标准评估工具。在 MRI 上,可以在背外侧看到周围脑脊液的帽状结构。在腹侧,肿瘤会融入脑干,通常很难确定肿瘤在哪里结束,脑干的功能部分从哪里开始。信号特征为T1序列低信号,T2序列高信号。与弥漫内生型病变相比,T1和T2的肿瘤边缘通常是一致的, 而与T1序列相比, T2 序列通常有更大范围的信号异常区域。与 CT 一样,静脉注射造影剂后可见明亮的强化(图 20.10)。
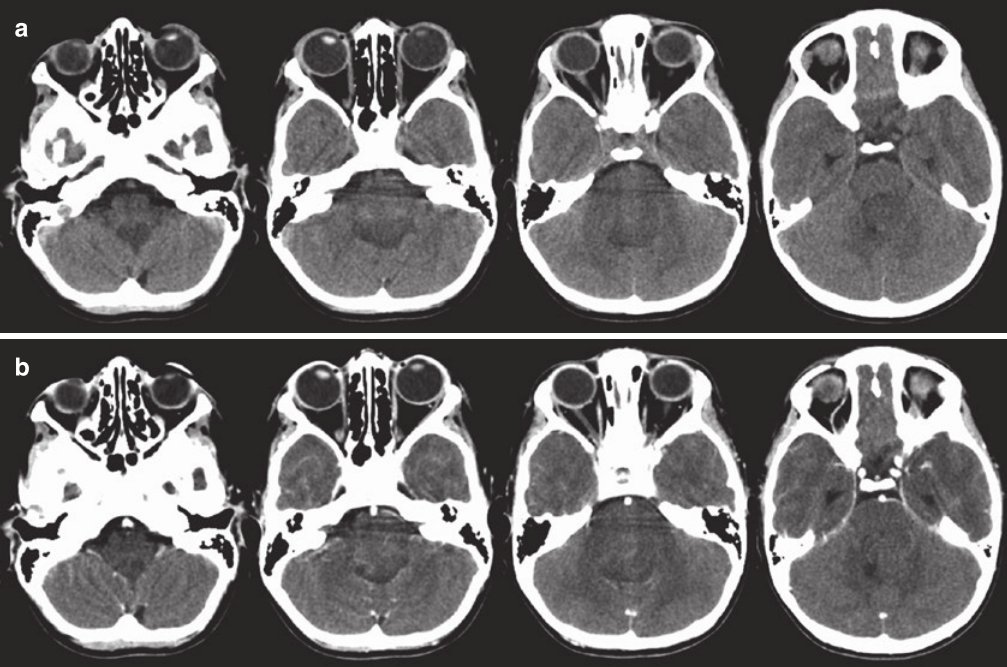
图20.9 一名 12 岁男孩背侧外生脑干胶质瘤的 CT 扫描,有 5 个月的病史,逐渐加重的肢体笨拙、共济失调和复视。 (a) 无对比的轴位 CT 扫描显示填充四脑室的轻微低密度病变。 (b) 对比剂给药后,病灶呈斑片状、不均匀强化。背侧脑干病变边界没有得到很好地显示
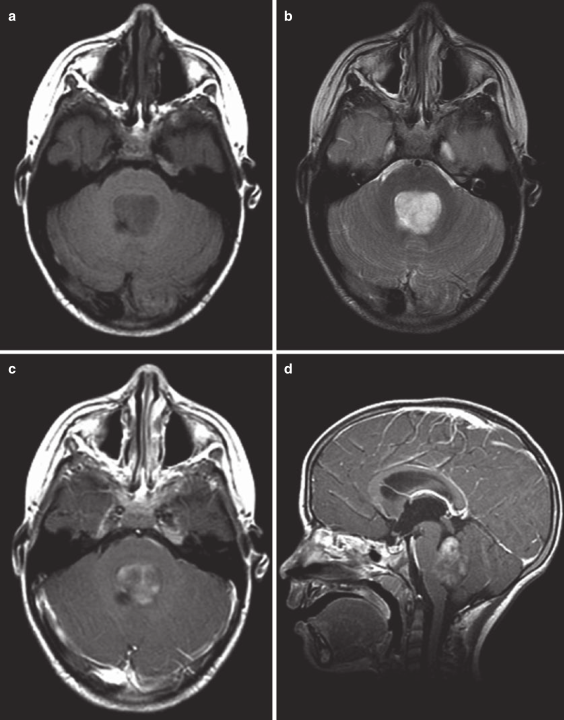
图20.10 背侧外生脑干胶质瘤的 MRI 扫描。 (a) 轴位 T1 MRI显示病灶与四脑室底直接相对。 (b) 轴位 T2 MRI 显示四脑室中的高信号病变。 (c) 轴位 T1 MRI 对比显示病变有些斑片状强化。 (d) 矢状位 T1 MRI 对比 CT 显示肿瘤与四脑室底部的关系,分辨率高于 CT
临床分类
背侧外生型胶质瘤主要是毛细胞性星形细胞瘤,很少发生间变性、高级别病变或神经节胶质瘤。 较一致的生长区域是通过阻力较小的路径,通过四脑室的室管膜。 这些病变是局部复发的,很少表现出远处播散或转移的迹象。
治疗方法
由于手术技术和神经影像学的现代进步,大多数背侧外生型脑干胶质瘤适合手术切除。而这些病变以前一直被认为无法手术,而如今由于显微神经外科技术的进步,术中神经电生理监测(IONM)和神经导航的出现,背侧外生型脑干胶质瘤越来越能够更好地接近。在标准枕下开颅和硬脑膜打开后暴露四脑室背侧外生型占位后,通过使用超声波抽吸器 (CUSA)和双较烧灼逐步切除肿瘤(图 20.11)。术中超声也是判断切除范围的有用辅助手段,术中磁共振iMRI也是如此。需注意不要在四脑室底部的估计平面以下切除肿瘤。IONM 的反馈有助于决定何时何地停止神经外科切除术。术后并发症通常以现有术前共济失调、测距障碍、眼球震颤和颅神经功能障碍加重的形式出现。
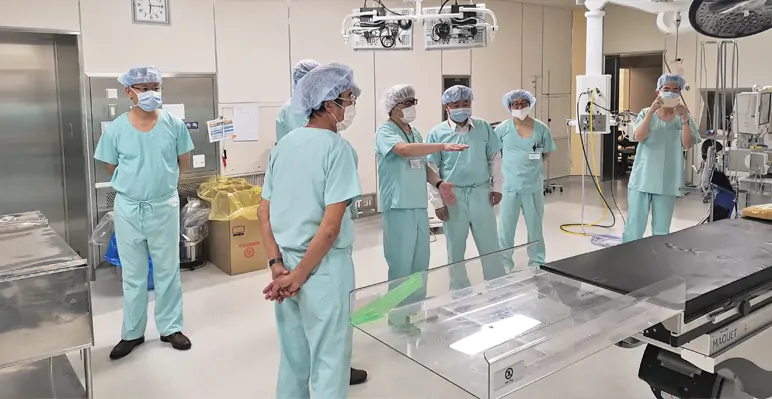
图20.11 (a) 后颅窝病变的标准中线入路,适用于背侧外生型脑干胶质瘤。患者俯卧位固定(上图),进行小的局部中线剃发。(b) 枕部中线暴露进行时要记住两侧横窦的定位。如图所示进行开颅手术。四个钻孔用于准备用于去除颅骨的开颅器。小心识别枕骨大孔的唇部,以免在使用开颅器时造成硬脑膜撕裂。(c) 硬脑膜以 Y 形方式切开并反折,其边缘用钉缝线固定。(d) 小脑半球被轻轻,暴露四脑室。显微镜用于切除肿瘤,注意不要在任何时候越过四脑室底部。或者,可以使用经髓帆入路进行肿瘤切除
对于那些已经复发且难以进行进一步的切除手术的患者,可能需要放射治疗。通常,在 6 周内分 30 次给予 54 Gy。 在许多系列中,放射治疗后的肿瘤控制被描述为普遍有利的。如今,随着已知的针对儿童低级别胶质瘤的生物学靶向,背侧外生性脑桥胶质瘤可能适合化疗。过去,卡铂和长春新碱有被使用。 现在,随着各种 BRAF 突变和融合异常的发现,目前正在探索 BRAF 控制剂疗法。
预后及生存质量
背侧外生型脑干胶质瘤中,毛细胞病变的总体 5 年存活率良好,大多数研究中的存活率约为 95%。即使肿瘤大体完全切除也能识别复发,因此 5 年无进展生存率在 54% 至 72% 之间。其他使生存恶化的因素是出现时的颅神经(特别是外展神经)功能障碍和症状持续时间少于 6 个月。与部分(< 总肿瘤质量的 50%)切除相比,低级别脑干病变的全切或次全切除已被证明具有更好的结果。背侧外生型病变手术后的长期神经功能通常良好,大多数患者均有所好转。
尽管背侧外生型毛细胞性胶质瘤的预后良好,但较少见的纤维状胶质瘤的预后可能差。各种新的模式正在被研究,包括增强对流和缓流递送化疗药物,放射增敏剂、基因治疗、高压和间质放射治疗。较后,对于这些肿瘤的分子生物学的更深入了解将导致靶向疗法治疗的改进。
Rutka教授较后总结性指出,儿童脑干肿瘤常根据临床表现和磁共振成像(MRI)进行诊断,这有助于将这些肿瘤分为影响中脑、脑桥和颈髓区域的亚组。尽管脑干肿瘤位于关键位置,但现在可以通过多种策略成功且顺利地切除脑干肿瘤,且随着分子遗传学的进展,儿童脑干肿瘤靶向治疗也有很大突破,这都将有助于提高总体生存率并较大限度降低复发率。新的给药方法如 CED 或 MRgFUS,应该有助于增加将靶向治疗浓度用于顽固性病变,例如 DIPG。希望这些这些方法将在患有这些损害性因素的儿童中获得越来越大的生存优势。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号