"医生,我接受了多次磁共振检查,能否据此判断我的胶质瘤属于良性还是恶性?能否确定具体是哪一级别的胶质瘤?"——这是许多胶质瘤患者共同关心的问题。临床上通常依据颅脑磁共振来诊断肿瘤的位置、形态、生长特性及其与关键神经结构的关系。然而,在精准医疗发展的背景下,只有通过手术或活检获取肿瘤组织,并经病理检测后才能明确胶质瘤的具体类型。
我们先来看以下案例:16岁的小磊被诊断为"右侧额叶、岛叶低级别神经胶质瘤,浸润基底节和侧脑室"。肿瘤位置较深,且已浸润至基底节区,该区域属于大脑功能区,手术风险较高。医生认为很可能为低级别胶质瘤、进展缓慢,因此建议先保守观察一段时间。
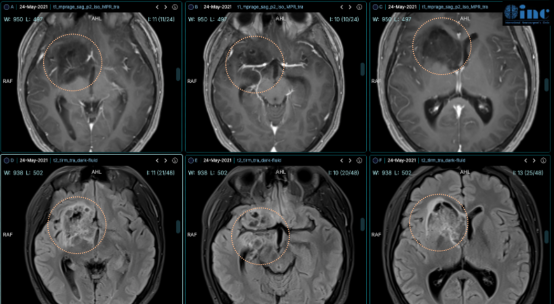
但小磊的父母担心拖延可能导致肿瘤恶化,果断联系了INC。在远程咨询INC巴教授过程中,与其他许多患者家属一样,他们非常关心:"这是胶质瘤吗?可能是哪个级别?属于恶性还是良性?"巴教授如何回应?
"该病变看起来确实是胶质瘤,但并非常见类型,而是一种较为少见的病变。关于是否为恶性肿瘤,我们不能仅凭磁共振影像确定,但我认为这不是高度恶性肿瘤,而是较低级别的病变。手术的目的在于缩小绝大部分肿瘤体积,并获得明确的组织病理学结果。
点击阅读小磊的故事:专访 | 胶质瘤DNET少年归来:"再千难万险都必须找巴教授!"
巴教授为小磊成功手术后的病理报告
在胶质瘤治疗中,分子病理检测常成为热点话题。患者及家属最常提出的疑问主要集中在检测的必要性、分子指标的临床意义及其对预后和治疗选择的影响。许多患者在检测前会犹豫"这项检查是否必须进行",而完成检测后则迫切希望了解"这些分子指标具体意味着什么,是提示预后良好还是不良,以及能为后续用药提供哪些指导"。

胶质瘤是中枢神经系统最常见的原发性肿瘤。近年来,随着分子生物学的发展,脑胶质瘤在分子病理领域取得了重大进展,已发现一系列有助于诊断和预后判断的分子标志物。然而,目前胶质瘤分子病理指标和检测规范尚未形成统一共识,因此中华医学会病理学分会脑神经病理学组结合国内外研究进展及实践经验,分享了胶质瘤中具有诊断价值的基因和染色体改变。那么,究竟什么是胶质瘤分子检测?
胶质瘤分子检测具体指什么?
分子检测又称生物标志物检测,是指在体内发现的某种分子,可作为某种疾病或异常状态的表现。在胶质瘤治疗中,生物标志物检测用于寻找基因、蛋白质及其他标志物的分子变化,其中DNA突变在此类变化中占据相当重要的部分。

分子病理检测的核心价值在于实现精准诊疗:
一、精准诊断方面:
胶质瘤的病理诊断已进入"形态学+分子特征"的新时代。正如"披着羊皮的狼",某些组织学表现温和的肿瘤,经分子检测可能被重新定义为高级别;而看似凶险的"披着狼皮的羊",分子分型可能揭示其真实的低恶性本质。这种诊断革新对胶质母细胞瘤等预后极差的肿瘤尤为重要。
二、精准治疗方面:
高通量测序技术的突破,使得基于特定分子标志物的靶向治疗成为可能。通过检测关键基因变异,不仅能预测传统放化疗的敏感性,更能为个体化靶向治疗提供科学依据,开辟胶质瘤治疗新途径。

胶质瘤常用分子病理学检测指标推荐
IDH1
遗传学变异:基因突变——以IDH1 p.R132H为主,其他少见突变类型包括p.R132C、p.R132S、p.R132L、p.R132G、p.R132V、p.R132P等。
检测方法:免疫组化,Sanger测序,焦磷酸测序,二代测序
诊断价值:胶质瘤分类的关键分子变异;可鉴别WHO 1级胶质瘤与胶质增生。
预后意义:提示预后相对良好;在临床试验中常作为重要分组指标;与MGMT启动子甲基化密切相关;对放疗和烷化剂相对敏感;潜在的治疗靶点(例如ivosidenib)。
IDH2
遗传学变异:基因突变——p.R172M、p.R172K、p.R172G
检测方法:Sanger测序,焦磷酸测序,二代测序。
染色体1p/19q
遗传学变异:联合缺失
检测方法:FISH,PCR,甲基化芯片/表达谱芯片/二代测序相关方法
诊断价值:1p/19q染色体臂的不完全或部分缺失不符合少突胶质细胞瘤的诊断标准,但可发生于IDH野生型胶质母细胞瘤病例。
预后意义:提示生长速度较慢,并对丙卡巴肼+洛莫司汀+长春新碱(PCV)联合化疗和替莫唑胺化疗更加敏感,总生存期明显延长。
H3 K27
遗传学变异:突变(K27M)
检测方法:免疫组化,Sanger测序,二代测序。
诊断价值:H3 K27变异型弥漫性中线胶质瘤(diffuse midline glioma,DMG)最常见的分子改变是H3 p.K28M/I(K27M/I)突变。
预后意义:预后相对较差;可作为潜在治疗靶点(例如EZH2抑制剂)。
H3 G34
遗传学变异:突变(G34R/V)
检测方法:免疫组化,Sanger测序,二代测序
诊断价值:H3 G34突变型弥漫性大脑半球胶质瘤(diffuse hemispheric glioma,H3 G34-mutant,H3 G34 DHG)是一组发生在大脑半球的弥漫浸润性胶质瘤,伴有H3.3(H3-3A,也称为H3F3A基因)p.G35(G34)R/V突变。
预后意义:生存期比IDH突变型胶质母细胞瘤略长,但比IDH突变型WHO 4级胶质瘤短。
ATRX
遗传学变异:突变
检测方法:免疫组化,Sanger测序,二代测序
诊断价值:在IDH突变的成人型弥漫性星形细胞瘤中,IDH1/2基因突变与ATRX基因失活突变和TP53基因突变存在明显相关性,而在少突胶质细胞瘤中,ATRX基因为野生型。此外,ATRX基因突变或蛋白表达缺失还常见于H3 K27变异型弥漫性中线胶质瘤、H3 G34突变型弥漫性大脑半球胶质瘤及具有毛细胞样特征的高级别星形细胞瘤中。
预后意义:相对于IDH突变型胶质母细胞瘤预后较好。
TP53
遗传学变异:突变
检测方法:免疫组化,Sanger测序,二代测序
诊断价值:TP53基因突变常见于IDH突变型星形细胞瘤、H3 K27变异型DMG、H3 G34突变型DHG中,部分IDH野生型胶质母细胞瘤也有TP53基因突变。
CDKN2A/2B基因
遗传学变异:纯合性缺失
检测方法:FISH,qPCR,MLPA,甲基化芯片/表达谱芯片/二代测序相关方法
诊断价值:在有IDH突变,且组织学表现符合2或3级星形细胞瘤者,如同时存在CDKN2A和/或CDKN2B基因纯合性缺失,则要整合诊断为CNS WHO 4级的IDH突变型星形细胞瘤。此外,应注意CDKN2A未发生纯合性缺失是儿童型MAPK通路改变型弥漫性低级别胶质瘤的必要诊断标准之一。
预后意义:在IDH突变型胶质瘤中预后较差。
TERT
遗传学变异:启动子突变(C228T/C250T)
检测方法:Sanger测序,焦磷酸测序,二代测序
诊断价值:在少IDH突变型胶质瘤,主要为少突胶质细胞瘤,常伴有TERT基因启动子突变,可辅助其诊断;而成人型IDH野生型弥漫性胶质瘤存在TERT基因启动子突变应整合诊断为IDH野生型胶质母细胞瘤(CNS WHO 4级)。
预后意义:在IDH野生型胶质瘤中预后较差;在IDH突变型胶质瘤中预后较好。
染色体7/10
遗传学变异:全第7号染色体获得/全第10号染色体丢失
检测方法:FISH,二代测序,微阵列芯片
诊断价值:全第7号染色体获得伴全第10号染色体丢失(+7/-10)在IDH野生型胶质母细胞瘤中的发生率高达80%。在IDH野生的成人型弥漫性胶质瘤,即使组织形态表现为WHO 2~3级,且无肾小球样血管增生和假栅栏样坏死,如出现+7/-10则整合诊断为IDH野生型胶质母细胞瘤(CNS WHO 4级)。
预后意义:在IDH野生型胶质瘤中预后较差。
EGFR
遗传学变异:扩增
检测方法:FISH,数字PCR,二代测序,微阵列芯片
诊断价值:星形细胞瘤,IDH突变型,WHO 4级胶质瘤的诊断指标之一;胶质母细胞瘤,IDH野生型,WHO 4级胶质瘤的诊断指标之一。
遗传学变异:EGFRvIII重排
检测方法:RT-PCR,数字PCR,免疫组化MLPA,二代测序
诊断价值:EGFRvIII发生在约半数EGFR扩增的胶质母细胞瘤中。
预后意义:靶向治疗的潜在靶点。
BRAF
遗传学变异:突变(BRAFV600E)
检测方法:免疫组化,Sanger测序,焦磷酸测序,二代测序
诊断价值:BRAF p.V600E突变是指BRAF蛋白第600位缬氨酸残基(V)被谷氨酸残基替换(E),可发生在儿童型低级别弥漫性胶质瘤、节细胞胶质瘤、青少年多形性低级别神经上皮肿瘤、毛细胞型星形细胞瘤、多形性黄色瘤型星形细胞瘤及上皮样型胶质母细胞瘤中。
预后意义:靶向治疗的靶点(例如vemurafenib)。
MGMT
遗传学变异:启动子区甲基化
检测方法:甲基化特异性PCR,焦磷酸测序,甲基化微阵列
诊断价值:MGMT基因启动子甲基化常见于IDH突变的胶质瘤中,在少突胶质细胞瘤中发生率为60%~80%。
预后意义:具有MGMT基因启动子甲基化的胶质瘤患者对放疗、PCV或替莫唑胺治疗敏感,生存期延长,故其为独立预后因素。
FGFR
遗传学变异:融合基因(FGFR-TACC)
检测方法:Sanger测序,二代测序,qPCR
诊断价值:在胶质源性肿瘤中,FGFR1基因变异,包括FGFR1基因内部串联重复(ITD)及FGFR1基因热点突变,可发生在儿童型弥漫性低级别胶质瘤中的MAPK通路变异型弥漫性低级别胶质瘤中;毛细胞型星形细胞瘤中可出现FGFR1-TACC1基因融合或FGFR1基因突变。而在青少年多形性低级别神经上皮肿瘤中,主要为FGFR2或FGFR3基因融合,但需要注意的是FGFR2-SHTN1(KIAA1598)、FGFR2-INA及FGFR3-TACC3的基因融合变异也可见于其他实体肿瘤中。
预后意义:可作为靶向治疗的潜在靶点(例如FGFR抑制剂)。
ZFTA
遗传学变异:基因融合(C11orf95-RELA)
检测方法:FISH,NGS
诊断价值:联合应用L1CAM和p65免疫组织化学染色对于ZFTA-RELA基因融合阳性室管膜瘤的诊断具有更好的效果。
预后意义:ZFTA-RELA基因融合阳性室管膜瘤中出现CDKN2A和/或CDKN2B纯合性缺失是预后不佳的独立预测因子。
YAP1
遗传学变异:基因融合(YAP1-MAMLD1)
检测方法:FISH,NGS
诊断价值:诊断YAP1融合阳性型幕上室管膜瘤的特异性标志物。
预后意义:发生该融合的幕上室管膜瘤患者预后相对较好。
NF1
遗传学变异:突变
检测方法:Sanger测序,NGS
诊断价值:在视路胶质瘤和IDH野生型胶质母细胞瘤中突变频率较高。
预后意义:携带该突变的毛细胞型星形细胞瘤预后相对较好。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号