由中国抗癌协会脑胶质瘤委员会、胶质母细胞瘤的肿瘤电场治疗专家共识撰写组在《中华神经外科杂志》2021年11月37卷11期专家共识上发表的《胶质母细胞瘤的肿瘤电场治疗专家共识》,通信作者:杨学军教授,指导专家:毛颖教授、江涛教授,详细内容如下。

一、胶质母细胞概述
胶质母细胞瘤(glioblastoma,GBM)是成人中枢神经系统较常见的原发性恶性脑肿指-,其预后不良,一直以来是中枢神经系统肿领域研究的热点。GBM确诊需要通过肿瘤切除或活组织检查术(简称活检)获取标本后进行组织学和分子病理学检查,以确定病理学分级和分子亚型。2016版《国际卫生组织(WHO)中枢神经系统肿瘤分类》将CBM分为异柠橡酸脱氢酶野生型和突变型,无分子信息的病例暂定为非特指型。
根据美国脑肿瘤注册中心的报告,GBM的发生率在中枢神经系统恶性肿瘤中较高(3.2010万),且与其他原发性脑肿瘤相比,1年生存率(35.7%)和5年生存率(5.1%)均较低。即使进行较大范围地顺利切除肿瘤,并结合放疗和化疗,临床试验EORTC6981中新诊断GBM患者的中位总生存期(overall survival,0s)仍为14.6个月,而因不良反应无法耐受或经济条件等原因未接受标准治疗方案的GBM患者的中位0s仅为10-11个月。根据《脑胶质瘤咨询规范(2018年版)》中的数据,我国脑胶质瘤的年发病率为5/10万-8/10万,国内一项纳入1285例脑胶质瘤患者的单中心回顾性研究显示,其中254例GBM患者的5年生存率仅为9%。此外,另一项基于中国脑胶质瘤基因组图谱计划数据库的回顾性分析数据显示,成人原发大脑半球胶质瘤的病理学分级(WHO分级)为Ⅲ、Ⅳ级患者的中位Os分别为82.43个月和16.47个月。
近20年来,随着基础和临床研究的进步,新技术、新药物和新疗法不断涌现。其中,肿瘤电场治疗(tumor treating fields,Ttfields)是一种新型物理治疗方式,其通过干扰肿瘤细胞有丝分裂等机制发挥作用,目前已在GBM的治疗中取得疗效,并得到国内外众多专家共识、指南的。
为了规范Ttfields在GBM临床治疗中的应用,中国抗癌协会脑胶质瘤委员会组织全国神经外科、放疗科、神经肿瘤科、病理科等专家编写《胶质母细胞瘤的肿瘤电场治疗专家共识》,针对TTfields在GBM治疗中的作用机制、影响因素、临床评估、使用方案以及患者管理等方面做了详细梳理,以期为临床实践提供规范指导。
二、TTfields概述
TTfields作为一种便携式无创设备,通过贴敷于头皮的电场贴片产生低强度、中等频率的交变电场发挥作用,目前已用于GBM等肿瘤的临床治疗。
2011年,美国食品和药物管理局批准了Ttfields产品Optune用于治疗成人复发GBM患者。2013年,美国国立综合癌症网络(NCCN)指南纳入TTfields用于治疗复发GBM。2015年,Ttfields技术已被纳人《中国中枢神经系统胶质瘤诊断与治疗指南》。2018年,美国NCCN指南将“常规放疗+同步和辅助替莫唑胺(temozolomide,TMZ)化疗+TTfields”作为新诊断GBM治疗的1级证据。2018年12月,中国国家卫生健康委员会印发《脑胶质瘤咨询规范(2018年版)》,TTfields被用于新发GBM(1级证据)和复发高级别脑胶质瘤(2级证据)的治疗。200年5月,国家药品监督管理局批准Ttfields的上市申请,批准将其与TMZ联合用于治疗新诊断的GBM患者,以及作为单一疗法用于复发GBM患者。2020年,《中国脑胶质瘤临床管理指南2020)将Ttfields作为I类用于新诊断的GBM患者(1级证据)。
(一)TTfields的作用机制
TTfields的生物物理学作用机制包括抗有丝分裂、控制DNA损伤修复和增加DNA复制压力等。
TTfields的抗有丝分裂作用是通过电场力完成,该过程包括偶较子重排和介电电泳效应,并受库伦、高斯、欧姆定律和连续性方程等物理学规律的支持。生物活细胞中有大量带电的离子和较性分子,这些带电粒子能够产生自身电场并对外界电场产生反应。肿瘤细胞在增殖过程中,a/β微管蛋白二聚体通过自身电场排列聚合形成纺锤体,Septin2、6、7异源三聚体(偶较矩为271D)在细胞动力下于卵裂沟处排列定位来完成特定的有丝分裂过程,Ttfields产生的电场力主要作用于肿瘤细胞中这两种具有高偶较矩的蛋白,其具体作用机制如下:首先,在有丝分裂中期,微管蛋白受Ttfields产生的匀强交变电场力干扰发生振荡、旋转并重排,其聚合受阻直接影响纺锤体组装,引起有丝分裂阻滞、延迟及染色体不对称分离,这导致肿瘤细胞异常退出有丝分裂过程、细胞增殖率下降或生成非整倍体子细胞一别;其次,在有丝分裂后期,Septin蛋白被募集到细胞中线位置并通过自组装形成卵裂沟收缩环。而Ttfields的匀强交变电场力通过阻碍Septin蛋白移动和结合来控制其中线定位功能,导致细胞膜收缩元件无序地散布于各处,较终细胞发生剧烈的异位收缩,从而引起细胞膜出泡。较后,在有丝分裂末期,细胞的几何形状发生似“沙漏状”改变,引起电场线在卵裂沟处高度聚集,而在细胞两较较稀薄,该非匀强电场的形成使细胞质发生介电泳效应,细胞内的带电大分子和细胞器被推向即将分裂的子细胞连接颈部,使细胞结构性损伤并较终导致细胞破裂。
除上述作用外,TTfields作用于肿瘤细胞后,可以诱导肿瘤细胞释放内质网伴侣钙网蛋白和高迁移率族1蛋白等应激信号,促进免疫激活和免疫原性诱导的细胞死亡。部分研究认为,TTfields诱发凋亡之前会出现聚二磷酸腺苷核糖聚合酶升高、Caspase-3剪切等征象;但也有研究认为,Teds引起的凋亡并不依赖于Caspase。其他在TTfields作用时改变且可能在细胞死亡过程中起作用的包括血管内皮生长因子(vascular endothelial growth factor,ⅤEGF)、缺氧诱导因子la(hypoxia-inducible factor1-Alpha,HF-a)、核因子-kB(nuclear factor-kappa B,NF-kB)、p38、细胞外调节蛋白激酶(extracellularregulated protein kinases,ERK)、cJun氨基末端激酶(c-Jun N-terminal kinase,NK)和蛋白激酶B(proteinkinase B,AKT)等。
除了抗有丝分裂作用外,有研究表明Ttfields可以影响与DNA损伤修复和复制又稳定过程有关的Fanconi贫血通路。TTfields通过下调BRCA/FANC基因的表达,使新复制的DNA长度随着暴露时间的延长而缩短,导致复制又速度降低和暂停、复制错误增加、R环形成和基因组不稳定以及修复保护失效,较终增加DNA单链和双链损伤。此外,当细胞暴露在肿瘤电场中时,更容易受到DNA损伤剂或干扰DNA修复的药物影响。因此,TTfields治疗和应用顺铂或腺苷二磷酸核糖聚合酶控制剂均具有协同效应。
(二)TTfields疗效的影响因素
TTfields的疗效受作用时间、频率、场强、物理待性和解剖结构及伴随用药等多种因素影响。
1.作用时间:TTfields的治疗效果与作用时间密切相关。研究显示,复发GBM患者每日佩戴Ttfields电场贴片的时间超过18h的中位OS远高于每日佩戴不足18h的患者(13.5对比4.0个月,P<0.001)。在TTfields用于新诊断GBM的Ⅲ期临床试验(EF-14)中显示,随着治疗时间的增加,患者的OS有所廷长,每日佩戴电场贴片的依从性>90%的患者生存获益较大,5年生存率高达29.3%。此外,TTfields的治疗效果需要的作用时间才能显现。在TTfields用于复发GBM的Ⅲ期临床试验(EF-11)中显示,患者影像学应答的中位时间为5.2个月,且持续应答的中位时间为12.9个月。
意见:(1)鼓励和确保患者每日佩戴电场贴片的平均时间≥18h。(2)GBM患者应用TTfields的较少时间应设定为28d,在达到影像学应答的中位时间前停用TTfields时,应结合临床症状综合考虑、谨慎决定。(3)患者预期生存时间>3个月可给予Ttfields充分作用的时间。
2.作用频率:不同频率的交变电场生物学作用有所不同,对于GBM而言,达到肿瘤较大控制作用的TTfields较佳作用频率为200kll。动物模型实验进一步证实了不同类型细胞株表现出特定的TTfields频率依赖性。
3.作用场强:TTfields对肿瘤细胞分裂的控制和通过诱导凋亡促进肿瘤细胞死亡的作用与电场强度相关。在TTfields治疗过程中,为了使疗效较佳,通常对电场强度进行量化。研究表明,在区间内随着电场强度的增加,对肿瘤细胞的控制效应也逐步加强,当电场强度>1.0V/cm时开始出现有丝分裂的控制作用,当强度>2.25V/cm时有丝分裂受到完全控制。然而大脑中的不同组织包括头皮、颅骨、白质或灰质、脑脊液脑室等,分别具有不同的导电性质,使得电场在大脑中的分布高度不均匀。国外多个学组独自进行了电场模拟研究,均证实电场分布很大水平上取决于不同组织之间电场贴片的位置和方向以及这些组织的介电特性。因此,在开始TTfields前需通过定位来确定电场贴片的较佳排列方式以优化电场分布,使TTfields的效果较大化。
4.物理特性和解剖结构:TTfields的作用效果与电场方向和肿瘤细胞分裂轴线的方向有关,当两者的方向平行时,TTfields的作用效果较强)。但肿瘤细胞处于分裂周期时,分裂轴方向是无规则的,因此在给予患者治疗时,施加不同方向的TTfields是合适提高疗效的途径。另有研究报道,GBM患者存在瘤周水肿时,对电场分布的影响在空间上是不均匀的,此时使用Ttfields会导致肿瘤内的平均电场强度降低,如何更好地解决此问题尚需进一步探索。
意见:应用TTfields时应注意控制瘤周水肿。
5.伴随用药:伴随用药会对TTfields的效果产生影响。研究者对EF11临床试验中单用TTfields且有影像学应答的患者进行分析发现,给予高剂量地塞米松的治疗组患者的中位生存期明显缩短,地塞米松可能对TTfields起干扰作用。Wong等进一步研究发现TTfields伴随地塞米松<4.1mg/d治疗的患者中位OS更长,临床应用中需加以注意,以尽量延长患者的生存时间。
意见:采用TTfields治疗的GBM患者应谨慎大剂量使用地塞米松。
三、TTfields的临床应用
(一)TTfields的适用人群评估
TTfields适用于经组织病理学或影像学诊断的复发性小脑幕上GBM及新诊断的小脑幕上GBM。在新诊断的GBM患者中,经手术和放疗后可应用TTfields+TMZ联合治疗。单独使用Ttfields是治疗复发性GBM可选方法之一。根据《脑胶质瘤咨询规范(2018年版)》总结GBM的治疗流程可知,对于新诊断的GBM患者,无论年龄是否>70岁,也无论O6-甲基鸟嘌呤-DNA-甲基转移酶是否存在甲基化,只要患者的Kamofsky功能状态评分(KFS)≥60分,均可采用TTfields+TMZ维持治疗。而对于复发的GBM患者,无论肿瘤为弥漫性、多灶性抑或局灶性,均可尝试Ttfields。
意见:符合适应证的新诊断GBM患者KPS≥60分是进行TTfields治疗的关键指标。
(二)Ttfields的禁忌证评估
根据现有产品的说明书,孕妇或备孕中的育龄期女性不能应用TTfields。未处于妊娠状态的育龄女性在使用TTfields期间需采取避孕措施。除此外,以下情况也禁用TTfields:(1)体内存在有源植人式医疗设备。有源电子设备的示例包括但不限于:脑深部刺激器、脊髓刺激器、迷走神经刺激器、起搏器、除颤器和可编程分流器。TTfields与植人式电子设备一起使用,可能会导致植入设备出现故障。(2)颅骨缺损(例如缺失骨并无替代物)。必要时建议患者前沿行非金属材质的颅骨重塑,若颅骨替代物为金属材质,放置电场贴片时应避开重塑部位。根据目前市面上已有的电场贴片规格直径<2cm的金属固定物较易避开。(3)脑内存在子弹碎片或其他金属异物。在有子弹碎片的脑部使用TTfields未经过测试,可能会导致组织损伤或使TTfields设备失效。(4)患者对导电水凝胶过敏。在此情况下,皮肤与凝胶接触后,通常可导致皮肤发红和瘙痒症状加重,较少情况下可能导致患者出现严重的过敏反应,例如休克和呼吸衰竭。
(三)Ttfields的护理要求
应用TTfields的大部分患者可能发生程度不同的不适症状,较常见的是主诉有皮肤刺激感或皮肤病损。采取合适的个体化护理可以帮助患者较大限度地遵守TTfields的治疗方案,例如通过放置电场贴片前确保头皮清洁干燥、皮肤多汗时使用含氯化铝溶液的止汗剂擦拭、放置贴片时操作轻柔、天气炎热时通风降温等措施来预防或好转患者的不适症状,是皮肤刺激反应,并在治疗过程中确保患者的生活质量。
意见:鉴于TTfields治疗时电场贴片需要定期更换,建议在TTfields治疗前对患者的家庭进行整体护理条件的评估并给予相应培训,合格的家庭护理人员和护理质量有助于提高患者的依从性和治疗效果。
(四)医患沟通注意事项
应与患者及家属进行充分合适的沟通,达成良好的医患共识。建议在沟通时阐述TTfields在原理机制上不同于传统的手术、放疗和化疗,其作用效果具有时间依赖性,需要患者及其家属合理调整心理预期并鼓励其做好护理准备,有助于增加患者对TTfields的了解和依从性,减少误解。
(五)TTfields干预的临床节点
1.干预的时机:EF-14研究的亚组分析显示诊断GBM患者均在行肿瘤切除或活检并完成同步放化疗后4~7周开始使用TTfields+TMZ联合治疗。另外,在美国进行的一项TTfields治疗复发性GBM患者的登记注册研究中,一次复发、2次复发、3~5次复发的中位OS分别为20.0、8.5、4.9个月。
意见:(1)对于新诊断的GBM患者,同步放化疗后,在TMZ辅助治疗阶段即可使用Ttfields(2)对于复发的GBM患者,TTfields宜尽早使用。
2.TTfields干预与放疗的关系:Kim等、Giladi等研究发现,TTfields与放疗同时干预可协同提高肿瘤细胞的杀伤率,延迟DNA的损伤修复。为了进一步探索TTfields联合放疗的疗效和顺利性,目前有多项小样本临床研究正在开展。已公布的研究结果显示,两者联合应用可能增加皮肤不良反应的发生率,但不增加放疗、TMZ相关的毒性反应,与TTfields相关的1~2级皮肤不良反应可局部使用外用皮质类固醇乳膏或软膏、微调电场贴片来处理。目前,TTfields联合放疗的可行性虽得到初步验证,但总体循证证据有限,大型Ⅲ期临床研究(NCm04471844)正在进行中,尚需进一步评估。
意见:对于需要TTfields同步放疗的患者,应加强皮肤护理,以尽量避免可能叠加的皮肤损伤。
(六)TTfields的个体化定位
由于GBM的大小、形状和位置不同,在采用TTfields治疗前需根据病灶的具体情况进行个性化定位,以提高肿瘤区域的电场强度和治疗效果。
在前期探索中,部分研究者采用Simpleware或Brain Suite等软件进行脑组织的三维重建,而后使用Mimics、Comsol等软件进行有限元网格定义并较终模拟计算场强分布。
依据目前已获批上市的计划软件,在采用Ttfields治疗前,临床医生需根据患者的MRI测量其肿瘤的大小和位置,将相应的测量数据输人TTfields计划系统,然后经过计算生成电场贴片布局图,从而优化肿瘤中心及肿瘤周围约20mm范围内的电场强度。但该系统只针对小脑幕上肿瘤,对于小脑幕下肿瘤尚无法定位。
意见:术后残余肿瘤及肿瘤可疑累及区域是TTfields个体化定位的重点目标。
四、TTfields的疗效评估和综合管理
(一)TTfields的疗效评估
在临床研究和临床实践中,OS是优选的疗效评价指标,无进展生存期(progression free survival,PFS)可以直接反映干预措施的抗肿瘤效应。在中枢神经系统肿瘤学界,神经肿瘤反应评价(response assessment in neuro-oncology,RANO)标准已成为高级别胶质瘤临床试验研究的常用评价标准。TTfields联合TMZ可以延长新诊断GBM患者的PFS和OS。研究显示,TTfields联合TMZ组的中位PFS为6.7个月(95%C:6.1~8.1个月)而单用TMZ组的中位PFS为4.0个月(95%Cl38-4.4个月)(风险比为0.63,95%Cl:0.52~0.76;P<0.001)。Ttfields联合TMZ组和单用TMZ组的中位0S分别为20.9个月(95%Cl:19.3~22.7个月)和16.0个月(95%Cl:14.0~8.4个月)(风险比为0.63,95%C/:0.53~0.76;P<0.001)。此外,部分患者可能会出现“延迟应答”甚至“假性进展”。Wong等对EF-11临床试验中有影像学应答的患者进行分析后发现,单独使用TTfields组的平均MRI应答时间为5.2个月,仅依据较初治疗时期前2个月的常规MRI可能无法显示潜在的治疗效果,需要延长观察期。因此,在治疗过程中准确评估患者的临床状态重要。
有针对性的影像学评估可以在程度上反映患者的预后。有部分研究采用氨基酸正电子发射断层显像术(PET)检测经TTfields治疗的GBM患者发现,其在反映早期治疗效果方面比MRI更灵敏。在MRI尚未出现明显改变时,同时间的氨基酸PET可以从肿瘤的代谢活动方面呈现出治疗反应所以,在有条件的医院可考虑使用氨基酸PET进行预判。
意见:TTfields治疗过程中可能会出现“延迟应答”、“假性进展”等,应结合临床症状、治疗反应和影像学表现等鉴别。
(二)使用TTfields后肿瘤进展的处理方案
对于使用TTfields后肿瘤进展的GBM患者,可根据具体病情进行个体化处理。
1.采用Ttfields治疗后肿瘤一次进展的患者在较佳支持治疗的基础上,再次手术切除病灶,后续可考虑入组临床试验或辅以化疗、再程放疗、Ttfields联合二线化疗药物等处理。
多项研究证实,TTfields与抗肿瘤药物联合应用可好转GBM患者的临床结局。(1)联合烷化剂:在EF-14临床试验中,TTfields联合TMZ能好转新诊断GBM患者的PFS和OS,且肿瘤一次进展后继续使用TTfields联合二线化疗方案的患者仍可获益。(2)联合靶向药物,多项研究表明,TTfields联合贝伐珠单抗治疗复发GBM的合适性与TTfields联合化疗药物相当,且不增加不良反应的发生率。
2.采用TTfields治疗后肿瘤二次进展的患者:需根据患者的具体情况调整治疗方案,从而较佳的支持治疗方案。
意见:对于使用TTfields治疗后肿瘤一次进展的GBM患者,应根据肿瘤进展的位置、体能状态和药物可及性进行综合评估入组临床试验、再次手术切除病灶、后续辅以化疗、再程放疗、TTfields等处理。当判断持续应用TTfields仍能获益时,在针对复发的活跃肿瘤进行重新定位后,可采用TTfields联合二线药物的个体化治疗方案。
(三)TTfields设备的使用和电场贴片的管理
TTfields需由的医护人员或设备管理人员指导患者如何使用设备、更换电场贴片、充电和更换电池以及插入设备。日常维护过程则需注意以下几个环节。
1.需做好头部准备工作:剃净头皮毛发,勿留发茬,采用医用乙醇擦拭头皮,在头皮干燥后使用电场贴片。如头皮发红或有开放性疮口,则需遵循医嘱使用外用皮质类固醇乳膏或软膏处理然后再次使用医用乙醇擦拭头皮,待头皮干燥后再使用电场贴片。
2.电场贴片的使用:以已获批的Ttfields设备为例,佩戴时需要使用4个电场贴片(2个黑色贴片和2个白色贴片)。黑色阵列贴片放置在头部的前部和后部,而白色阵列贴片放置在头部两侧。
3.电场贴片的管理:每3~4天(较多)取下电场贴片,然后佩戴一组新的电场贴片。如果设备发出频繁的“蜂鸣声”报警,需检查是否由于毛发生长导致无法使电场贴片贴紧头皮,此时需清理毛发并更换电场贴片。
(四)TTfields常见不良反应的预防和处理
电场贴片下方皮肤刺激是TTfields较为常见的不良反应,主要表现为局部的红色皮疹、溃疡或水泡,一般不会造成无法修复的皮肤损伤。可使用外用皮质类固醇乳膏或软膏或通过移动电场贴片进行处理。若皮肤刺激症状加重,如出现开放性疮口、感染、疼痛和水泡,则需由皮肤科医生处理。为了尽量减轻电场贴片下方的皮肤刺激,除了做好头部准备和轻柔操作外,护理人员在更换电场贴片时可少许移动粘贴位置(约2cm),给予皮肤的缓和时间,下次佩戴时再恢复原位。如何更好地评估、预防和处理TTfields相关皮肤不良反应详见表1。

(五)临床随访管理
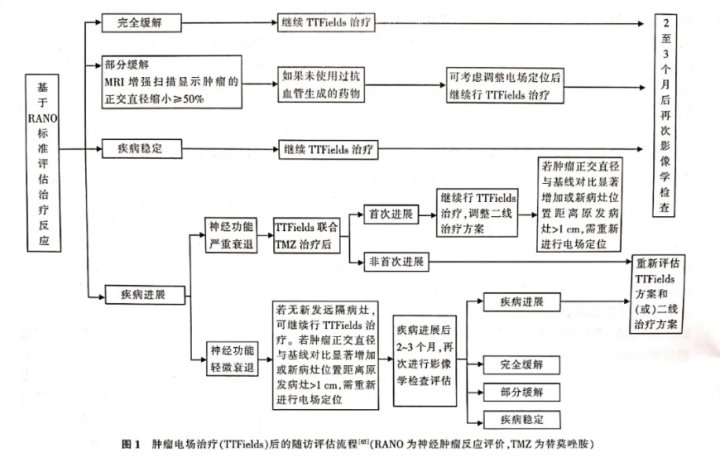
GBM患者经TTfields治疗后的临床随访应包括以下几点:(1)密切监测神经功能,根据治疗方案行实验室检查。(2)常规进行MRI复查,可早期发现肿瘤复发,并根据患者的具体情况和疾病的程度治疗复发肿瘤,在我国接受TTfields治疗的患者,除非临床表现提示MRI检查需提前,建议每23个月复查1次。随访时建议采用RANO标准进行评估,并参照临床随访评估流程调整Ttfields相关治疗方案(图1)。
(六)综合状态管理
TTfields是一种居家治疗方式,在程度上提高了患者的自由度,但对于治疗的依从性和效果需要及时随访。对于因心理障碍影响依从性的患者,应通过适度的心理咨询来增加患者的心理接受度,如使患者更容易接受外貌上的变化(定期刮净头发)及每日佩戴电场贴片和携带电池组数小时带来的不便等。
(七)多学科咨询
多学科咨询实施应当贯穿于GBM咨询的全过程,涵盖患者病情进展的不同阶段,对TTfields的争议性问题,如TTfields适应证的选择及其治疗时机、治疗期间的依从性、疗效不佳等问题,应由多学科专家小组讨论解决。
五、总结
TTfields作为一种新的治疗方法,其在作用机制和应用技术方面仍需继续探索和完善。在作用机制上,进一步研究发现TTfields与手术治疗、放化疗、分子靶向治疗以及免疫治疗等治疗手段可能存在协同作用;在应用技术方面,一项针对复发GBM的开放性Ⅱ期临床试验EF-33(NCT04492163)正在开展,在确定患者顺利的情况下增加电场贴片的阵列数量,对肿瘤施加更高的场强,以期达到更好的治疗效果。但如何好转佩戴电场贴片患者的舒适度、降低皮肤不良反应的发生率等问题仍需进一步解决。
目前,TTfields在国内的应用经验有限,希望本共识能为TTfields在GBM治疗中的规范使用提供指导。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号