脊索瘤(Chordoma)是一种起源于胚胎期脊索残余组织的肿瘤。其生物学行为具有侵袭特性。肿瘤好发于颅颈交界区(Craniovertebral Junction, CVJ)——该区域作为连接大脑和颈椎的关键结构,由枕骨大孔、寰椎(C1)和枢椎(C2)构成狭窄通道,内部走行脑干、脊髓及椎动脉等重要结构。脊索瘤常发生于寰椎间隙并逐渐扩张。
尽管部分脊索瘤生长较为缓慢(例如某些病例三个月内体积变化不大),但位于此类神经关键区域的病变均具有高风险:压迫脑干可导致呼吸暂停,累及颈髓可能引起四肢瘫痪,若阻塞椎动脉则可能继发脑梗死。
手术治疗是脊索瘤的主要干预方式。但由于病变常紧密包绕神经血管结构,手术切除面临较高难度。成功的手术需在保护神经功能的前提下实现肿瘤全切(Gross Total Resection, GTR)。术后常需辅助质子治疗等放疗手段以延缓复发。
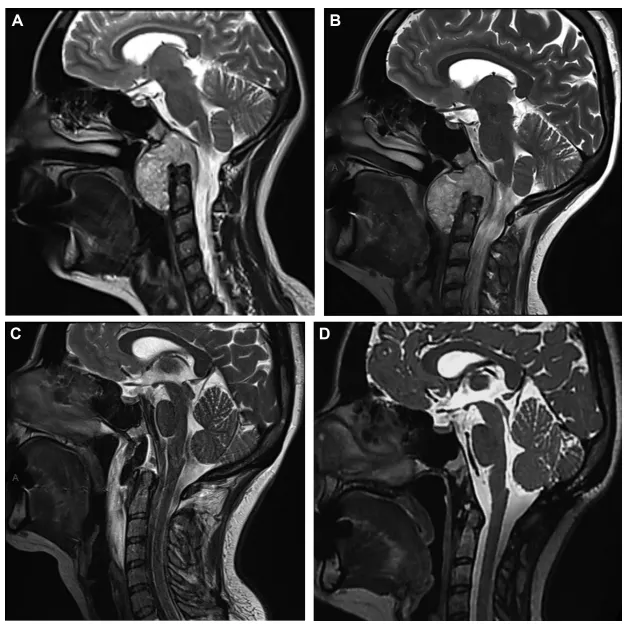
如图为MRI所示一例颅颈交界区脊索瘤,其术前肿瘤生长速率(Tumor Growth Rate, TGR)较低(3.53%/月):A:术前3个月;B:术前1天;C:术后48小时,提示肿瘤全切;D:术后14个月(已接受质子放疗),未见复发征象。
随着医学研究的进展,临床针对脊索瘤的治疗策略正在不断优化。
脊索瘤复发可否预测?肿瘤生长速率具有预测价值
目前手术切除程度仍是评估脊索瘤复发及预后的最可靠指标。脊索瘤作为一种罕见且具有局部侵袭性的原发性骨肿瘤,即使实现全切并联合放疗,其复发率仍较高。
部分患者术后可维持较长期的无进展生存期后才出现复发。除切除程度外,学界已探讨多种预后相关因素,包括质子束放疗以及组织学与分子特征。然而,这些指标多需术后评估,难以用于术前决策。因此,在手术风险较高的颅底区域,建立有效的术前预测体系对制定个体化治疗方案显得尤为重要。

近年来,肿瘤生长速率(TGR)作为一种基于影像学的量化指标,可反映肿瘤体积随时间动态变化,已在多种肿瘤中被证实与无进展生存期相关。Froelich教授团队的研究系统评估了TGR在脊索瘤中的预测价值。对32例患者的分析显示,TGR ≥ 10.12%/月的患者无进展生存期更短(P < 0.0001)且复发风险更高(OR = 26)。若同时伴有Ki-67标记指数 ≥ 6%,复发风险将进一步增加(P = 0.0008)。
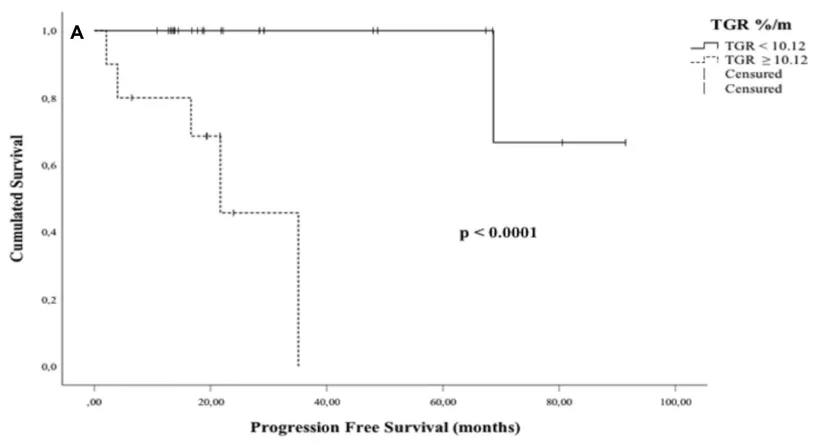
该研究为脊索瘤术前风险评估提供了重要依据。TGR作为无创性影像学指标,有助于识别高侵袭性与高复发风险的脊索瘤,从而优化临床治疗策略及术后随访方案。
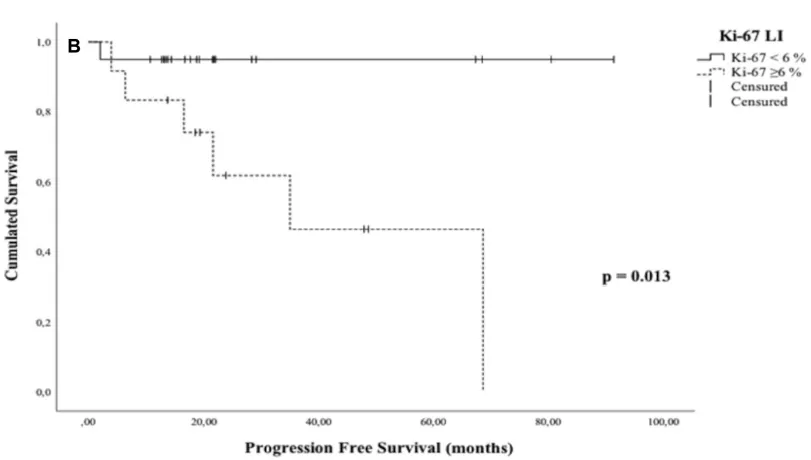
Kaplan-Meier法绘制无进展生存(PFS)曲线:A:按术前TGR分层;B:按Ki-67标记指数分层。
现有文献多关注术前MRI信号特征或临床-影像学联合指标的预后价值,该研究首次验证TGR作为脊索瘤治疗前侵袭性评估的术前预测指标。

除切除程度与Ki-67指数外,肿瘤生长速率的临床意义
作为国际知名的脊索瘤手术专家,INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员、世界神经外科联合会(WFNS)颅底手术委员会前主席Sebastien Froelich教授(福洛里希教授,"福教授")在该领域具备丰富的临床经验。
福教授及其团队从事脊索瘤研究超过20年,拥有国际范围内较大规模的脊索瘤患者群体,迄今成功治疗近300例脊索瘤,其中超过80%为高难度颅底及颅颈交界区病变。
多数患者在转诊至福教授团队前已接受过手术,增加了治疗复杂性。该团队持续探索脊索瘤治疗领域,积极寻求新型治疗手段。
如何降低脊索瘤复发风险?
脊索瘤复发率较高,因此手术应力求完全切除。多数患者出现症状时肿瘤体积已较大(超过3-5厘米),且常包绕脑血管、颅神经及脑干等重要结构。在保障安全的前提下最大程度切除肿瘤,并联合术后放射治疗(尤其是质子治疗),有助于提高患者总生存率。
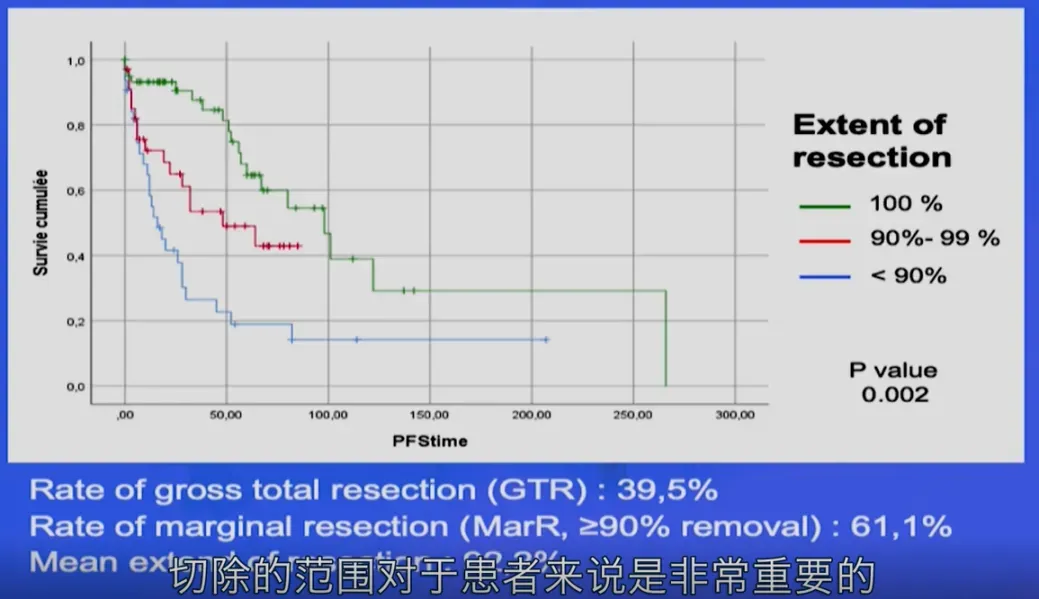
最大范围的手术切除联合术后辅助放疗,是延缓脊索瘤复发及改善预后的关键措施。
脊索瘤患者的治疗路径
选择一家专注于脊索瘤、具备高效协作能力的MDT(多学科诊疗)中心至关重要。此类中心拥有专业团队,能基于患者具体情况制定合理治疗方案,从治疗初期即提供系统化、有序的诊疗。科学的MDT模式对改善脊索瘤患者预后具有显著影响,术前KPS(Karnofsky功能状态)评分同样具有重要意义。

在法国,绝大多数脊索瘤患者于专科研究所或科室接受治疗,该中心也接诊来自欧洲其他国家的患者,因而积累了丰富的病例经验,能够迅速理解并个体化处理每位患者的病情。
中国作为人口大国,未来的发展方向应是建立若干脊索瘤诊疗中心,集中收治脊索瘤患者并组建经验丰富的神经外科团队。放疗方面,因脊索瘤对放疗呈相对抵抗性,需接受较高剂量照射,其治疗复杂性超过脑膜瘤等其他病变。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号