颅咽管瘤因其中线、深部位置及与重要神经血管结构的密切关系,一直是神经外科医师的难题。临床表现和潜在的手术发病率表明,该肿瘤的良性方面是其组织学分级。手术治疗的目的是在辅助放射治疗的基础上实现全切除(GTR)或次全切除(STR)。近年来,后一种治疗策略因其降低发病率、同等无进展及总生存率而受到青睐。然而,神经外科知识和肿瘤与正常神经解剖学的关系往往是切除程度的较终决定因素。作为神经外科医生,需注重维持生活质量以及肿瘤的长期控制和生存。在INC国际神经外科顾问团成员、国际神经外科杂志《Journal of Neurosurgery》主编、加拿大多伦多大学儿童医院Sickkids大外科主任及脑瘤研究中心主席James T.Rutka教授的《Microsurgical removal of craniopharyngioma:endoscopic and transcranial techniques for complication avoidance》论文中讨论了外科手术切除的常用方法,并强调减少并发症的可能性的技术考虑。
鼻内镜入路(EEA)
将内镜引入经蝶窦入路增强了解剖的可视性,同时提供了直接的肿瘤入路和较小的脑回缩。该手术通常与耳鼻喉科医师共同进行,负责提高鼻中隔皮瓣和较初的经鼻部分手术。然后,由耳鼻喉科医生通过一个鼻孔提供内镜观察,通过另一个鼻孔提供显微外科手术器械。这种团队方法已被证明在众多研究中取得了良好的患者预后。
虽然截骨的外侧范围受到颈内动脉的限制,但颅底减压的延伸包括鞍结节和蝶面扁平,好转了对鞍上和交叉后区域的通路,从而实现了更广泛的肿瘤切除(图1)。这也扩展了以鞍上肿瘤为靶点的方法的实用性。在儿科人群中,这项技术更具挑战性,因为有一个与有限的空间和较小的基底膜相结合的蝶窦。在此,对术前影像学研究的仔细回顾将决定EEA在儿童中是否可行。使用小的超声多普勒探头可以帮助术中鉴别颈动脉狭窄的儿童。
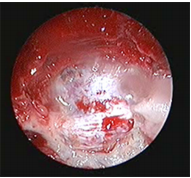
图1:10岁男童复发性颅咽管瘤的手术野与暴露。EEA提供了更广阔的视野,可以看到颈动脉侧面的沟槽和鞍结节的定位
术中导航可提高骨减压的准确性,以充分暴露肿瘤。建议去除以内视颈动脉腔隙(mOCRs)为界的内斜突,以进入视颈动脉池。这反过来又使肿瘤的顺利回缩和供应视神经、交叉和漏斗管的穿孔血管的早期识别成为可能。鞍结节的切除常导致海绵窦上段出血。先切开硬脑膜上、下窦及双较透热,可防止出血及手术野模糊。
为了防止脑疝,应打开硬膜以减少视野,同时限制需要修补的缺损的大小。还应注意保护正常垂体。一旦肿瘤暴露,就进行肿瘤去瘤以使囊膜和囊外分离成为可能。囊外剥离术是利用抽吸导管提供反牵引和蛛网膜粘连的清晰剥离,是预防神经血管损伤较强调的原则(见补充视频)。
鼻中隔皮瓣(NSF)具有较大的表面积和来自鼻中隔动脉的血管供应,在重建颅骨缺损和减少术后脑脊液泄漏方面发挥了重要作用(见补充视频)。从鼻中隔的下侧面分离皮瓣是困难的,因为有撕裂皮瓣的风险。由于NSF形成较早,并置于鼻咽部视野之外,因此应注意不要无意中损害其血管供应。在儿科人群中,人们一直关注是否有足够的区域来收获NSF。然而,Ghosh等人已经证明术前放射学评估可用于适当的患者选择。与经颅技术相比,经颅电刺激可提高GTR的发生率(66.9 vs.48.3%),好转视力(56.2 vs.33.1%),降低癫痫发作率。然而,CSF的泄漏率仍然相对较高。
儿童与成人颅咽管瘤:管理上的考虑
儿童颅咽管瘤的手术切除更具挑战性,因为其主要的病理亚型是金刚蛋白瘤。由于纤维化和炎症,这些表现为更多的囊性和钙化,表现时更大,与邻近的神经组织更粘连。成人则具有乳头状亚型,这种亚型具有较好的局限性,浸润性较差,因此更易于进行全切除。尽管如此,病理并没有显示出生存优势。
然而,儿童的预后较差,标准死亡率为17(成人为3.5)。这可能是由于不良预后因素的聚集,如;肿瘤体积越大,严重脑积水的发生率越高,肿瘤的复发率和术后肿瘤粘连的发病率也越高。手术并发症可导致全垂体功能减退和肥胖,从而使患者易患严重感染和2型糖尿病。由于代谢综合征(垂体机能减退)以及尿崩症和放疗,这些患者患脑血管疾病的风险也更高。因此,对中风危险因素的仔细监测和管理较近被提倡。在儿童中,由于辐射后动脉炎、认知功能障碍、继发性肿瘤和潜在的放射性坏死等不良后遗症,放射治疗很少被用作主要治疗手段。相比之下,患有小肿瘤的成人可以用放疗来防止病情恶化。在儿童次全切除后,放疗可以作为早期辅助治疗,也可以在肿瘤进展后作为晚期辅助治疗。两个年龄组的囊性颅咽管瘤可用减压手术来处理,如使用α-干扰素插入Ommaya储层。实体瘤需要术前影像学检查。蝶窦入路是外科医生优选的鞍内和鞍上肿瘤入路。在儿童中,这种方法通常是为3岁以上的儿童保留的,因为蝶窦充气应该已经开始。超声多普勒也被建议用于防止血管损伤的一个有限的访问区域。在交叉后肿瘤内侵进入三脑室时,手术选择包括经颅、内镜和经脑室路径。这些也可以组合使用。可能在患有这种肿瘤的儿童身上表现出比成人更强的攻击性更好。视交叉上病变是有问题的,术前冠状位MR序列对评估下丘脑受累程度是有用的。对于下丘脑高信号的病例,次全切除和术后放疗是优选的治疗方法。
次全切除(STR)与总全切除(GTR)
下丘脑累及是决定切除程度的主要因素。对于有下丘脑浸润的肿瘤,无论是术前还是手术时,较好前沿行次全切除,然后进行放射治疗。这是为了防止肥胖,暴饮暴食和神经心理障碍,引起的伤害,下丘脑。
分子生物学与颅咽管瘤治疗的未来
这两种病理亚型的颅咽管瘤已被发现有不同的潜在分子遗传学。在坚强瘤性颅咽管瘤中,60%-75%的患者的-连环蛋白(CTNNB1)外显子3发生突变,该外显子编码降解靶向基序。然而,在乳头状亚型中,高达95%的-连环蛋白(CTNNB1)编码降解靶向基序。然而,在乳头状亚型中,高达95%的肿瘤已发现癌基因BRAF(V600E)发生突变,这种突变影响MAP激酶/ERK信号通路,进而影响细胞分裂和分化。关于这些突变特别有趣的是,它们似乎专属于它们的组织学亚型,发病率和频率很高,而且是无性的,在全部肿瘤细胞中都有出现。此外,在这两种亚型中几乎没有其他的基因突变,提示这些致癌突变在肿瘤发生中起作用。
在乳头状亚型的情况下,这具有的治疗潜力,因为BRAF控制剂很容易获得,并在CNS和非CNS肿瘤中显示了疗效,其中突变是普遍的。事实上,对一名患有乳头状颅咽管瘤的男性患者进行了为期35天的BRAF控制剂dabrafenib和trametinib的试验,结果肿瘤体积减少了85%。该小组还能够检测到外周血样本中的BRAFV600E,从而避免了手术活检的需要。然而,该患者之前有过多次手术,这可能导致肿瘤DNA释放到体循环。剩下的是验证这种治疗作为一个大型随机对照研究的一部分。治疗的较佳频率、持续时间,以及它是更好地用作初级治疗、新辅助治疗还是用于复发病例,这些问题仍然没有答案。
James T.Rutka教授表示:在颅咽管瘤手术的术前规划中,关键的考虑因素包括肿瘤的主要位置(交叉前、鞍前或交叉后),以及肿瘤的位置与交叉的关系、下丘脑的附着和垂体在漏斗和柄中的位置。大而复杂的肿瘤可能需要联合入路。囊外分离对于维持邻近神经血管结构的完整是重要的。虽然完全切除可以避免放射治疗的需要,但不应以的发病率为代价。术前应仔细评估下丘脑受累的程度,如果受累明显,较好进行放射治疗的次全切除。应该强调的是,尝试进行颅咽管瘤全切除的患者应该在重症监护病房观察24-72小时,以便尽可能合适地监测和管理血清钠和尿量的波动。
INC国际神经外科医生集团:虽然外科手术仍然是颅咽管瘤的优选治疗方法,但很可能分子定向治疗将在未来这些肿瘤的治疗中发挥更大的作用。在这些复杂的手术靶点上使用BRAF控制剂的前景是很有希望的,如果转化科学取得成果,这将是一个较大的成功。
James T.Rutka是INC国际神经外科医生集团旗下国际神经外科顾问团(WANG)成员,在INC的协助之下,为我国难治肿瘤患者带来前沿的治疗设备和前沿的治疗方案,为患者提供新的治疗选择。国际神经外科顾问团(WANG)均由国际各地的神经外科协会主席级专家组成,他们分别代表美国、欧洲、日本乃至全国际高的神经外科水平,分别任职各自领域的国际相关协会主席。INC一直致力于中外神经外科技术的交流、合作、促进和提高,同时针对中国有需要的脑胶质瘤、脊髓肿瘤、脑血管畸形病变、动脉瘤等神经外科特别疑难手术病例,提供国际治疗咨询与协调服务。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号