由于GCTs发病相对少见、肿瘤成分多样、发病部位不同以及目前现有诊断方法的局限,导致颅内生殖细胞肿瘤GCTs的准确诊断面临诸多困难,临床容易误诊物治疗。GCTs是儿童颅内肿瘤成份较复杂、诊断较困难、治疗难度较大的一类肿瘤,若首诊医生对该类肿瘤认识不清,治疗措施不当,轻则延误治疗,重则容易致残致死。在2021年,国际卫生组织(WHO)5度更新了颅内生殖细胞肿瘤GCTs的具体病理诊断,并陆续更新相关咨询指南,本文结合2021年来病理诊断、咨询指南更新,整理如下GCTs咨询中的八大关键问题进行深入探讨。
1、GCTs发病位置什么特点?
2、GCTs分型有哪些?哪些分型预后好?
3、GCTs病理诊断的意义和局限:
4、AFP及β-HCG检测的意义和局限性:
5、GCTs诊断性放疗的争议
6、伽玛刀或质子治疗GCTs可行吗?
7、GCTs脑积水引流术和肿瘤切除,一次还是分次手术?
8、GCTs如何就诊及综合治疗?
1、GCTs发病位置有什么特点?
发病部位主要集中在鞍区(30%~35%)、松果体区(40%~45%)及底节(丘脑)区(<20%)少部分患者(<5%)病变可同时累及2个解剖区域,称之为双靶GCTs颅内其他部位少见。鞍区女性常见,首发症状为多饮多尿;基底节区男性常见,首发症状为一侧肢体力弱、笨拙;松果体区男性常见,1/3的患者可以出现Parinaud综合征7,常合并梗阻性脑积水。
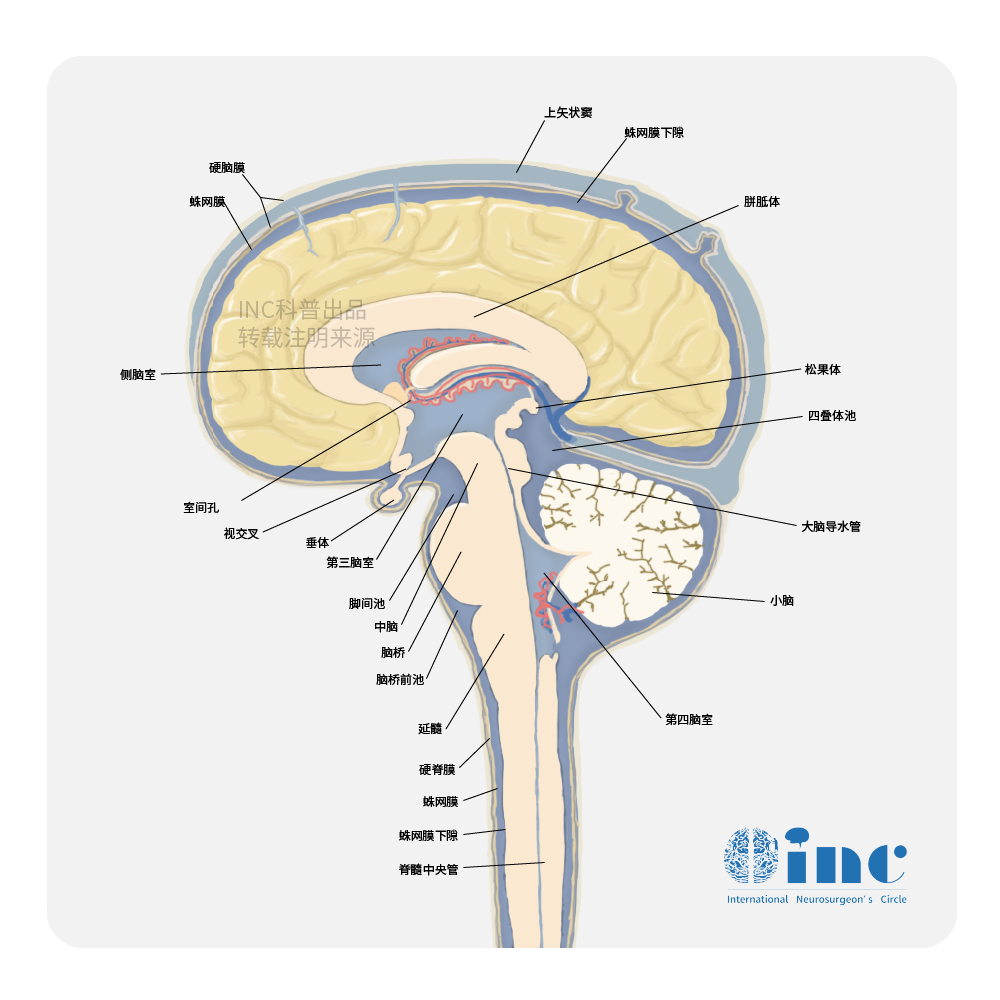
2、GCTs分型有哪些?哪些分型预后好?
目前研究认为,GCTs起源于原始性细胞,其在发育过程中出现分化障碍,引起染色体倍数异常,是导致肿瘤发生的可能机制。由于肿瘤是在原始性细胞发育的过程中产生,因此可形成不同亚型或不同成分混合的GCTs。依照2021年国际卫生组织(WHO)中枢神经系统肿瘤分类,GCTs分为生殖细胞瘤、胚胎癌、卵黄囊瘤(又称内胚窦瘤)、绒癌、成熟畸胎瘤、未成熟畸胎瘤、畸胎瘤恶性变及混合性生殖细胞肿瘤。
哪些分型预后好?
有学者提出了对治疗选择有指导价值的分类方法,根据预后不同分为如下三类:
预后良好组:单纯生殖细胞瘤,成熟畸胎瘤
预后中等组:含合体滋养层细胞的生殖细胞瘤、未成熟畸胎瘤、伴有恶变的畸胎瘤和你生殖细胞瘤或畸胎瘤为主要成分的混合性GCTs
预后不良组:胚胎癌、卵黄囊瘤、绒癌和以这三者为主要成分的混合性GCTs.
3、GCTs病理诊断的意义&局限:
病理学是肿瘤性疾病诊断的金标准,多数类型的肿瘤,是在手术切除的基础上获取肿瘤标本,因此标本充分,病理学分析更加多方位客观。在同一肿瘤标本中,同时存在预后截然不同的几种肿瘤成分的疾病少见。因此,即使是通过穿刺活检获得的病理学结果,对治疗决策的影响也较小。但对于GCTs,因其独特的发病机制和临床特点,使病理学诊断存在不确定性。
首先,GCTs的好发部位为颅脑深部,且周围毗邻重要功能结构,外科操作的技术要求高。其次,对于约占GCTs70%的生殖细胞瘤,单纯放化疗即可获得良好的疗效,手术的切除程度并不好转患者的预后。即使选择手术,也在快速冰冻病理学检查提示为生殖细胞瘤后终止手术。然而通过活检或快速冰冻病理学检查,均可因获取的组织较少而造成肿瘤成分的遗漏,特别是非生殖细胞瘤成分的遗漏,造成GCTs分型诊断的不准确。
此外,部分GCTs患者,肿瘤的体小或病变范围不清晰,例如鞍区GCTs,早期往往仅表现为垂体柄的增粗位于松果区的GCTs,部分患者仅在影像学上表现为钙化周围的少许软组织影;而位于底节区的GCTs,部分患者仅在MRI上表现为信号紊乱而无明显强化,或在CT上显示稍高密度影。这些均进一步增加了活检取材操作的难度。上述因素使得病理学诊断的可行性和可靠性受到影响。
以欧洲国际儿童肿瘤研究组(InternationalSocietyof PaediatricOncology,SIOP)有关GCTs的研究为例,该研究是迄今为止较大的一项关于GCTs的临床研究,共纳入190例经病理学诊断的生殖细胞瘤患者。随访至60个月时,共1例患者复发。复发患者中,2例初诊时血液和脑脊液的肿瘤标志物均为阴性,而复发时血液和脑脊液中AFP均增高;其中1例在复发后进行了手术,病理学诊断为卵黄囊瘤。据此推测,该2例患者在初诊时因肿瘤组织成分的取材遗漏,被“误诊”为生殖细胞瘤。
因此,对于GCTs,通过手术切除获取多量肿瘤组织为基础的、并行多方位病理学分析的诊断较为可靠。而对于接受活检的患者,无论是术中快速冰冻、还是立体定向、亦或是神经导航辅助下的组织活检,均可能因取材部位的局限性导致误诊或漏诊,特别是对生殖细胞瘤的诊断更应慎重。当然,在充分评估手术操作风险的基础上,采取多点取材的方式可降低肿瘤成分遗漏的风险。
4、AFP及β-HCG检测的意义和局限性
共识对于伴有β-HCG和(或)AFP增高的患者,结合典型影像学表现,可以考虑不进行组织病理学检查,即可确立GCTs诊断并据此进行治疗。除了血清中的肿瘤标志物外,还应检测脑脊液。因为脑脊液中肿瘤标志物的水平往往数倍于血清中的水平,因此敏感度更高,特别是部分血清中肿瘤标志物在正常范围内的患者,脑脊液中可能为阳性。因此,如无腰椎穿刺的禁忌证,脑脊液检查应列为必需检查的项目。
2015年,关于GCTs的共识指出,对于怀疑GCTs者,若血液和(或)脑脊液绒毛膜促性腺激素β-HCG)和甲胎蛋白AFP在正常值范围内,无论其影像学表现如何,需通过活组织检查确立诊断;若上述指标增高,同时伴有典型的影像学表现者,可以不需要活检即确诊GCTs,并可根据肿瘤标志物的提示,开始抗肿瘤治疗。
GCTs可能是目前惟一还可以依靠肿瘤标志物确立临床诊断的肿瘤性疾病,这也从另一个角度说明,在一部分患者获取病理学诊断确实存在操作层面的困难。需要强调的是,共识仅提出对于标志物升高的患者无需活检即可确立GCTs的诊断,但并没有排斥活检。因为仅依靠肿瘤标志物的增高,无法准确判断肿瘤是单一成分还是多种成分共存,甚至具体哪些成分共存。
目前,根据肿瘤标志物水平进行GCTs分型诊断标准的建议主要有2个:其中,SIOP的建议是,β-HCG≤50IU/L且AFP正常者,可按照生殖细胞瘤治疗;而对于β-HCG>50IU/L或AFP高于正常值者,应该按照NGGCTs治疗。美国儿童肿瘤研究组(Children′sOncologyGroup,COG)的建议是,β-HCG≤10IU/L且AFP正常者,可按照生殖细胞瘤治疗;β-HCG>10IU/L或AFP高于正常值者,应该按照NGGCTs治疗。
从上述两组织的标准可以看出,采用AFP判定NGGCTs诊断的意见是比较一致的:只要AFP水平增高,临床即可诊断为NGGCTs。尽管仍不能准确判断肿瘤的具体成分,但鉴于目前对GCTs的认识,并不影响制定治疗决策。因为到目前为止,除成熟畸胎瘤外,对含有NGGCTs任意一种或几种成分者,治疗原则并无差别。而对于单纯β-HCG增高的患者,上述两组织对于判定患者疾病类型的界值存在分歧。
目前,虽然尚无循证医学证据证明哪个标准更加准确,但是存在的分歧提示,单纯依靠β-HCG的增高进行类型判断是存在缺陷的:或者可能将生殖细胞瘤误诊为NGGCTs,而使患者接受了毒副作用反应更大的治疗,从而给患者的远期生存质量带来较大影响;亦有可能将NGGCTs误诊为生殖细胞瘤,而造成治疗强度不足,致使疾病复发风险明显增高。
5、诊断性放疗的争议
诊断性放疗又称试验性放疗,诊断性放疗的理论依据是,生殖细胞瘤成分对于放射线异常敏感,对于疑似GCTs的患者,给予20Gy的放疗,若病灶缩小,则判定为GCTs。该诊断方法的提出,主要是受限于当时的医疗水平。随着对本病认识的深入,诊断性放疗的诸多弊端逐渐显露,目前学界内对诊断性放疗的意见不一,主要争议的点如下:
首先,可能导致误诊,因为放疗后病灶的缩小甚至完全消失,并不能完全确立GCTs的诊断。例如,组织细胞增多症是一种原因未明的组织细胞增殖性疾病,目前认为其与自身免疫调节功能紊乱有关,常见于儿童和青少年。部分患者可以以垂体部位的异常信号为首发表现。由于其是一种增生性疾病,病灶的自发性缓解并不少见。即使是需要接受治疗的系统性病变,对放化疗也较其敏感,如果给予诊断性放疗,亦会出现异常信号的消失。再如,松果体实质细胞瘤及松果体母细胞瘤,也是青少年松果体区的常见瘤种。该类肿瘤对放疗中度敏感,给予剂量的射线照射,亦会出现肿瘤体积缩小。
其次,即使患者确实为GCTs,基于诊断性放疗确立的诊断,仍然无法准确区分生殖细胞瘤与NGGCTs。当非生殖细胞瘤成分较少或者含有畸胎瘤成分时,诊断性放疗后亦可表现为肿瘤大部分消失或肿瘤残存,基于此判断为生殖细胞瘤或NGGCTs,均会影响后续的治疗策略。
较后,对于诊断性放疗无效的患者,仍然需要行活检或手术获取标本行病理学诊断。而诊断性放疗对患者造成的损害、对后续病理诊断准确性的干扰、以及对制定后续放疗计划的负面影响均无法消除。因此,国际上从上世纪90年代就已经摒弃了诊断性放疗的应用,并在多个关于生殖细胞肿瘤的共识中提出,对临床上疑似GCTs的患者,如果肿瘤标志物为阴性,需进行组织病理学检查以明确诊断。
随着神经外科立体定向技术和神经内镜技术的发展,以及机器人在神经外科领域的应用,活检已经不再是难以逾越的技术屏障,完全可以取代诊断性放疗,提供更准确的诊断信息。对于确实无法通过手术或活检获取病理学诊断、且肿瘤标志物阴性的患者(如病变直径<1cm),可暂时观察并密切随访。期间可以给予对症治疗,在确诊之前不要贸然进行抗肿瘤治疗。
基于上述分析显示,现有的诊断手段均存在自身的优势及其局限性。因此,临床医生需要尽可能综合全部能够获取的信息,进行多方位分析和判断,这是现阶段GCTs准确诊断的必然要求。首先,对于疑似GCTs的患者,应进行肿瘤标志物和(或)组织病理学检查,获取肿瘤存在的直接证据,确立GCTs的诊断。在此基础上,还需要综合考虑病史、影像学表现及临床疗效等多方面因素,进一步区分生殖细胞瘤与NGGCTs。
AFP是判定存在非生殖细胞瘤成分的重要指标,无论是血液和(或)脑脊液中水平的增高(需排除肝功能异常等因素),还是肿瘤组织免疫组织化学染色阳性表达,均是确定NGGCTs的证据。对生殖细胞瘤的诊断要慎重,需要满足多个条件,如影像学的均匀信号(MRI)/密度(CT)、组织病理学无AFP阳性细胞成分、血液和(或)脑脊液β-HCG正常或轻度增高且AFP正常、诱导化疗后达到完全缓解等;否则,均应怀疑NGGCTs的可能性。
GCTs的诊断复杂。无论是通过组织病理学还是肿瘤标志物,均不足以单独用于GCTs亚型的区分。而鉴别生殖细胞瘤与NGGCTs,是GCTs治疗的重要重要内容,不同的诊断结果有着不同的治疗方案及预后效果。
6、伽马刀或质子治疗GCTs可行吗?
目前对此,学界内主流认识如下:伽玛刀属于局部治疗,不能控制生殖细胞瘤的播散转移;其次,伽玛射线和X射线属同类射线,生殖细胞瘤对其高度敏感;但伽玛刀是通过单次照射至肿瘤坏死,单次照射剂量高达13-18Gy25,远超生殖细胞瘤诊断性放疗(0.8Gy)和调强放疗(单次分割剂量1.8-2.0Gy)。X线分割治疗可以使肿瘤细胞周期再氧化、再分布,增加乏氧肿瘤细胞对放疗敏感性,较之伽玛刀顺利、合适。
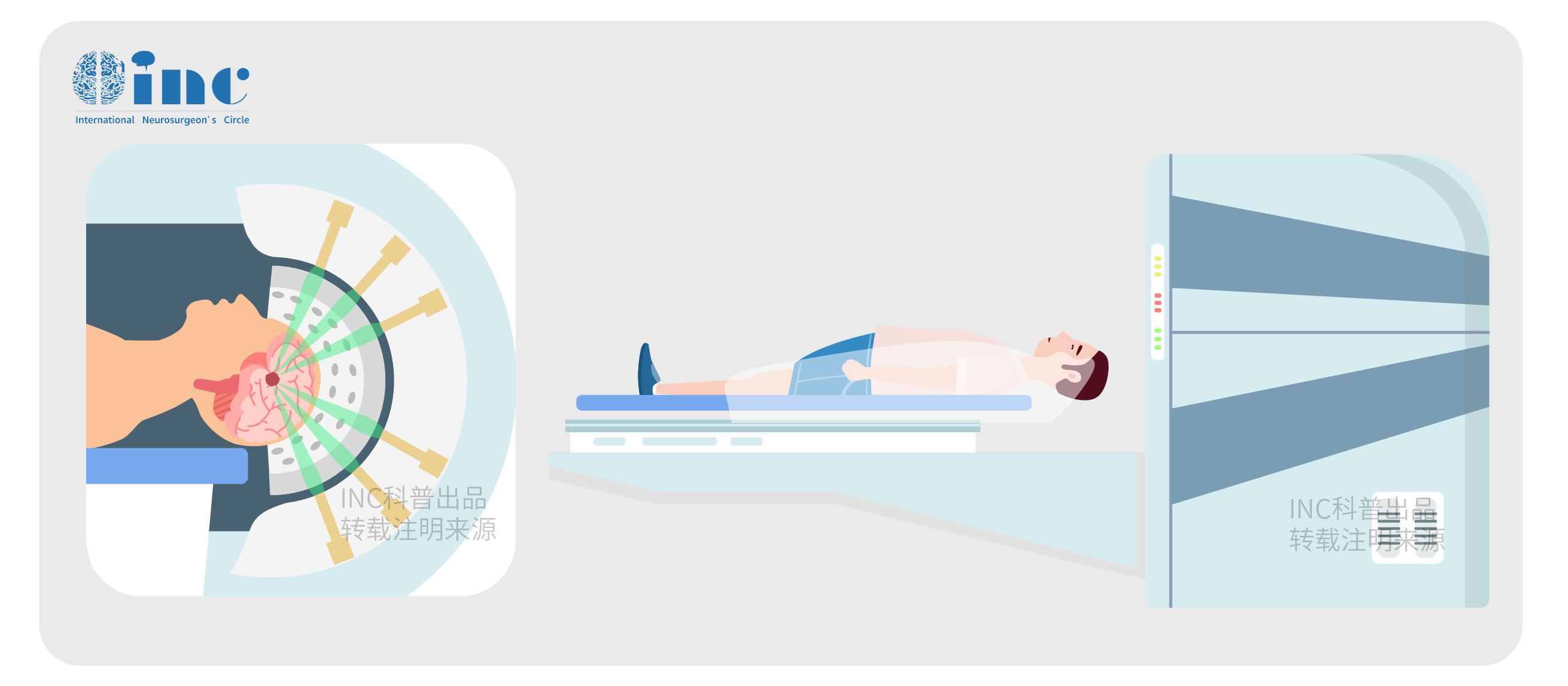
据国内外不少学者反馈,临床工作中经常遇到松果体区肿瘤伽玛刀治疗后,往往高剂量伽玛射线治疗造成瘤体坏死肿大,毗邻脑干丘脑水肿明显,甚至呈放射性坏死,已无手术可能,预后较差。需要指出,并不是儿童松果体区肿瘤都是生殖细胞瘤(生殖细胞瘤占松果体区肿瘤45%27),对于全部儿童松果体区肿瘤无差别地进行伽玛刀治疗,无科学依据,与治疗指南不符,效果差,目前临床中不伽马刀治疗GCTs。
质子治疗是目前较前沿的肿瘤放射治疗,通过调整质子射束顺利地提高肿瘤内的照射剂量,对临近器官损伤小。但利用质子刀治疗生殖细胞瘤的研究少,没有足够的证据支持其顺利性与合适性。
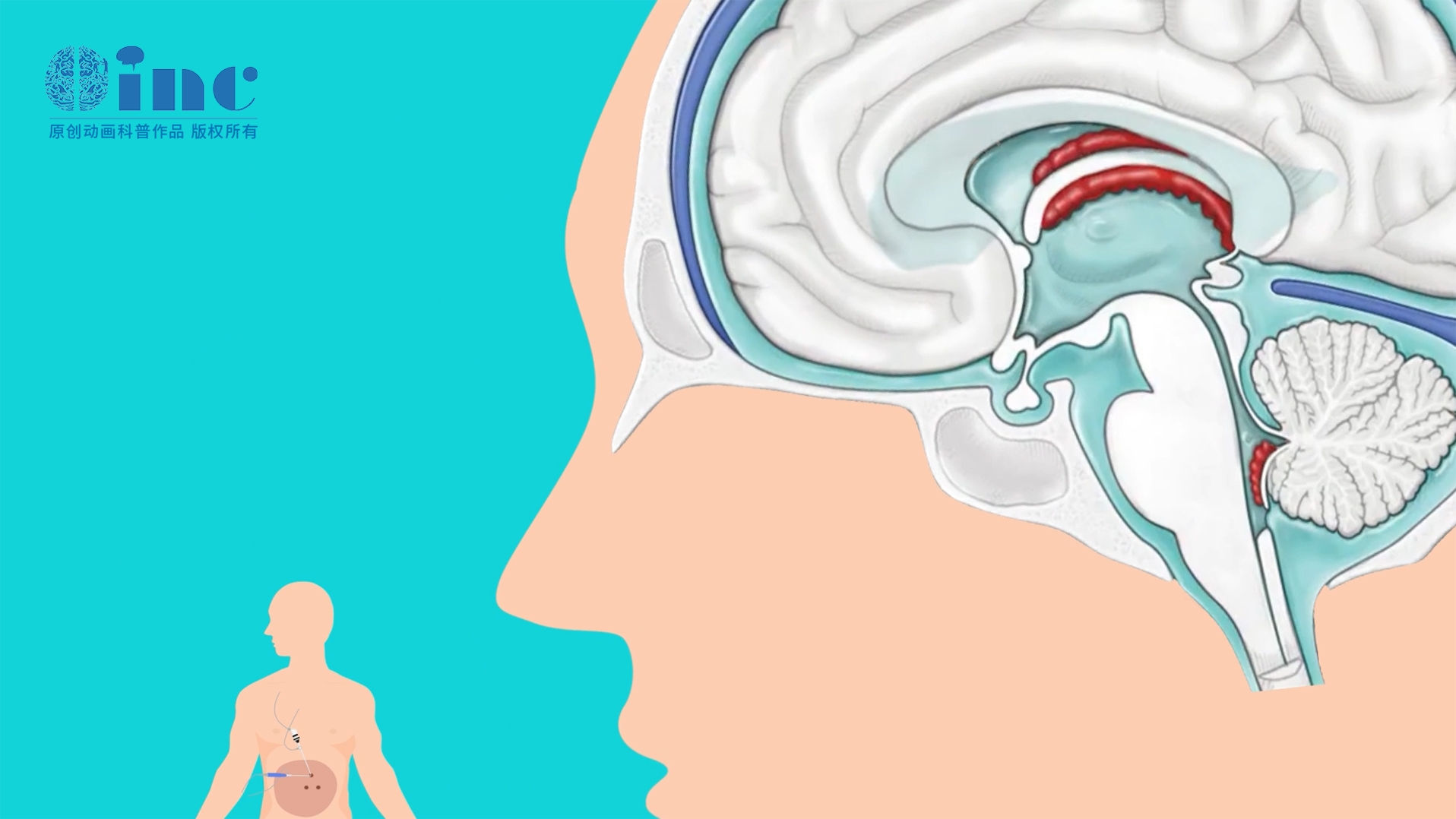
7、GCTs脑积水引流术和肿瘤切除,一次还是分次手术?
如何评价一次手术同时解决肿瘤和脑积水?目前不同经验、不同中心意见认识不一,这是和患者具体病情、诊治经验和能力直接相关的。有学者提出“一步走”,即通过一次手术,既实现肿瘤全切,又可打通脑脊液循环,合适缓解脑积水,这样可以避免二次手术,较快程度解除肿瘤占位,这样可以避免后续引流术后仍需要再次开颅肿瘤手术。但有不少同仁认为,这种方法风险大,可行性不足,他们认为:术后由于残渣、血凝块、止血材料的堵塞所致脑积水再发生率高达30%,轻则打断后续放化疗,重则危及患儿生命。若在脑积水未解除的情况下强行肿瘤切除,术中易出现急性脑膨出导致手术失败。虽然切除肿瘤也可以解决脑积水,但术前通常还是会行分流术来暂时缓解增高的颅内压,降低脑疝的潜在风险,因此通常是在开颅切除肿瘤之前放置脑室外引流管。
脑积水的处理:松果体区肿瘤早期的处理可能包含脑脊液分流术,因为急性梗阻性脑积水是一个较常见和主要症状。症状明显的脑积水,常急诊在床旁行侧脑室穿刺外引流术;在后续治疗中,内镜下三脑室造瘘术更优于脑室-腹腔分流术,特别是年轻患者,预期寿命长,ETV(内镜下三脑室造瘘术)能使患者避免很多VPS(脑室-腹腔分流术)潜在的并发症,如肿瘤细胞腹腔播散的风险。而轻度或无症状的脑积水则不需要处理,因为肿瘤手术切除后会重建脑脊液循环通路。
8、GCTs如何就诊及综合治疗?
在临床工作中,神经外科医生往往是首诊医生,准确施治,责任;一旦咨询失当,直接导致患儿致残致死,且无法补救。因此,越来越多学者专家提出神经外科医生应该全程把控生殖细胞瘤的全周期治疗,提出:
1).有经验的外科医生见到患者后,会对病情判断有不同的敏感性,这是多年职业训练的结果,是肿瘤内科医生难以比拟的。纵观国内外生殖细胞瘤的咨询指南,基本由肿瘤内科医生编写,过于重视化验指标,恰恰忽略了年龄、性别、首发症状、病史及病程这些对诊断生殖细胞瘤具有高度特异性的临床资料。因此,为了患儿治疗顺利,神经外科医生应该当仁不让,监控全周期治疗。
2).更为重要的是,由于肿瘤的异质性,在辅助治疗过程中,可能肿瘤标记物回归正常,但瘤体不缩小甚至增大,提示非纯生殖细胞瘤,需要手术治疗。由于有些化疗药物或放射方法、剂量会给手术造成较大困难,直至手术失败。因此,首诊的外科医生需与肿瘤科医生通力合作全周期参与治疗,即便治疗失败需要手术,经治的化、放疗方案也不至于给手术造成太大的障碍。
总之,手术、化疗、放疗是GCTs的主要治疗方案,治疗强调多学科整合咨询(MDT to HIM)的整合治疗方案,根据血清肿瘤标记物、肿瘤部位、肿瘤大小、患者症状和脑积水的严重程度整合判断决定整合治疗方案。放疗是GCTs的重要治疗方法,初单纯的成熟畸胎瘤,其余各种类型的GCTs一般需放疗,但对于儿童放疗对神经系统、发育的影响大。化疗也是肿瘤的重要治疗手段,对于分泌性GCTs。
手术在治疗中的目的和意义根据不同患者病情、手术中心经验及手术水平不同而不同,手术的重要意义包括:
- 解除肿瘤占位效应、解除颅高压效应
- 切除肿瘤
- 明确肿瘤具体病理及分型
- 治疗梗阻性脑积水。
对于松果体病灶引起的脑积水,可采用脑室镜下三脑室底造瘘术;鞍区GCTs引起的脑积水,可以脑室-腹腔分流术。对于畸胎瘤或其他非纯生殖细胞瘤性GCTs经化疗和/或放疗后仍残留的部分则需开颅手术切除。
颅内生殖细胞瘤治疗专家
德国Helmut Bertalanffy教授
德国巴特朗菲教授是国际神经外科联合会(WFNS)教育委员会主席、德国INI国际神经外科研究所神经外科教授、血管神经外科主任、国际神外杂志《Neurosurgical Review》主编。国际颅底、脑干肿瘤教授,专研复杂脑瘤手术30余年,擅长大脑半球病变、脑干病变、脑血管疾病、脑内深层区胶质瘤、颅颈交界处的病变等的肿瘤切除术、神经吻合术以及各种椎管内肿瘤切除术,拥有上千台脑干手术量,以高超的技术手法和顺利前提下高切除率手术而,在中国患者群中被尊称为“巴教授”。
加拿大James T.Rutka教授
James Rutka教授曾连续三年任职国际神经外科学院院长,同时还是美洲神经外科学院前院长、美洲神经外科医师协会主席,如今是当今国际神经外科杂志《Journal of Neurosurgery》主编,其自身发表了超过500多篇的文章,著有神经外科专著多本,在临床上的研究方向以颅内肿瘤为主,对胶质瘤、纤维瘤、颅咽管瘤、室管膜瘤、松果体区肿瘤等具有多年的临床经验,擅长儿童脑瘤和癫痫等外科治疗,包括间质激光热治疗(LITT)、清醒开颅术等显微外科手术。目前作为加拿大多伦多大学儿童病院脑肿瘤研究中心主席,Rutka教授带领的团队及Sickkid医院在小儿脑肿瘤手术和疾病研究方面在国际上都享有盛誉。
意大利Concezio Di Rocco教授
Di Rocco教授是国际神经外科联合会教育委员共同主席(2013-2017年)、国际神经外科联合会儿童神经外科委员会前主席、国际小儿神经外科杂志《Child´s Nervous System》现任主编、国际神经外科联合会基金小儿脑积水项目负责人、德国汉诺威国际神经科学研究所儿科神经外科主任。在儿科神经外科及科领域的临床治疗经验颇为丰富,是国际公认的儿科神经外科专家。自2014年5月起,就担任了德国汉诺威国际神经科学研究所(INI)的儿科神经外科主任。Di Rocco教授教授尤为擅长小儿神经纤维瘤、癫痫、脑积水、蛛网膜囊肿、颅缝早闭、脑和脊髓肿瘤、脑和脊柱畸形(半椎体畸形,皮质发育不良,脊髓脊膜膨出,脊髓内脂肪瘤,Arnold-Chiari畸形)等难治病症方面的治疗,进行过12,000多次神经外科手术。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号