新生儿确诊脑干高级别胶质瘤,生存希望渺茫,父母一度濒临放弃。然而令人震惊的转机出现:活检后肿瘤竟自发消退!
是否误诊?
组织学检测已明确诊断,但分子特征特殊:不属于任何已定义的儿童脑肿瘤分类。此案例源自鲁特卡(Rutka)教授近期发表的《先天性脑干高级别胶质瘤罕见消退:病例报告与文献综述》。
鲁特卡教授指出,先天性婴儿脑干高级别胶质瘤(HGG)极为罕见,治疗难度大,且通常预后极差。但此案例提示:可能存在预后较好的先天性脑干HGG亚型。
然而,类似自发消退案例报道极少,且对肿瘤类型要求严苛,其发生概率极低。对绝大多数高级别胶质瘤患儿而言,积极治疗争取长期生存更具现实意义。

PART 01 儿童高级别胶质瘤长期生存策略
综合《中国抗癌协会脑胶质瘤整合诊疗指南(2024版)》及《NCCN指南》,国内外共识均强调:多学科协作与个体化治疗+手术切除的核心地位。

为何手术切除至关重要?
缓解症状,延长生存期
安全最大化切除肿瘤可缓解颅内高压及占位效应症状。
多项研究证实:切除程度与患儿总生存期(OS)及无进展生存期(PFS)显著相关。
手术目标:延长患儿生存时间。
明确诊断,奠定治疗基础
术中获取足量组织用于病理确诊及分子检测,或可发现有效治疗靶点。
肿瘤切除范围越大,残留需放化疗的肿瘤体积越小。
手术为后续辅助治疗创造有利条件,并增强患儿对放化疗的耐受性。
辅助治疗新进展
鲁特卡教授在华期间与国内专家达成共识:

1. 免疫治疗的应用前景
靶向治疗:针对RTK融合基因(如NTRK阳性)使用TRK抑制剂。
联合治疗突破点:免疫治疗与MRgFUS(磁共振引导聚焦超声)联用。
探索方向:
CAR-T细胞疗法
疫苗疗法
过继性T细胞疗法(如PD-1抑制剂、纳武利尤单抗等检查点阻断治疗)
2. 药物治疗的联合应用
化疗药物:替莫唑胺、卡莫司汀等联合手术及放疗。
靶向策略:
H3 G34突变型弥漫性半球胶质瘤
H3 IDH野生型弥漫性高级别胶质瘤
潜力药物:ONC201对DIPG(弥漫内生型脑桥胶质瘤)前景可观(需临床试验验证生存获益,国内可及性低)。
3. 临床试验的探索价值
适用人群:髓母细胞瘤Group3/4亚型需专项试验。
前沿方向:
mRNA疫苗疗法
免疫治疗(尤其CAR-T细胞疗法)
分子靶向治疗(如贝伐珠单抗联合免疫治疗)
放疗新证:鲁特卡教授研究证实再程放疗对复发髓母细胞瘤及DIPG有效(中国可开展,惠及特定患者)。

PART 02 综合治疗实现长期生存案例
病史回顾
6岁患儿星星(化名)持续头痛伴间歇性左半身上身震颤。影像学显示:
双侧丘脑肿瘤(右侧更大,体积如橘)
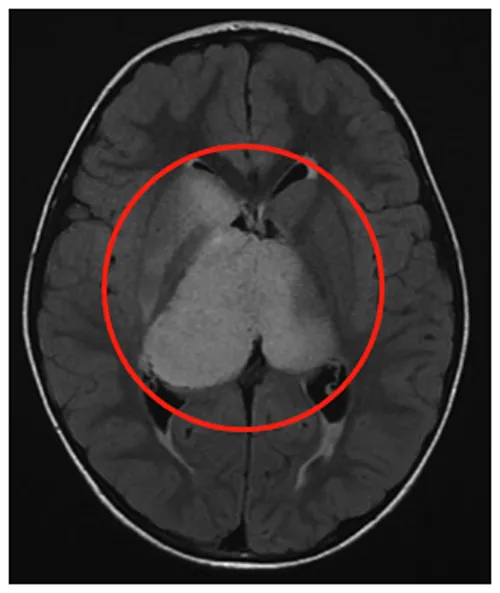
尾状核右头部受侵
脑室轻度扩大伴膈膜水肿
肿瘤内部明显囊变
手术治疗
手术目标:减轻肿瘤压迫,明确病理指导后续治疗。
操作步骤:
鼻中隔造瘘术
左枕脑室-腹腔分流术(缓解水肿)
病理结果:
WHO III级间变性星形细胞瘤
H3K27M、p53、BRAF V600E突变免疫阴性
MIB-1增殖指数40%
综合治疗
方案设计:鲁特卡教授制定个体化方案
治疗内容:
替莫唑胺(TMZ):200 mg/m² × 12周期
放射治疗:总剂量59.4 Gy
预后评估
确诊后1年随访显示:
影像学表现稳定
临床症状缓解
生活质量显著提升
长期生存希望明确


 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号