“我曾以为可以依靠反复手术维持一生,尽管肿瘤会复发,但生长缓慢,一年仅增长约1cm。”“已经接受过3次鼻内镜手术、3次开颅手术和2次放疗,甚至尝试了质子治疗,却仍间隔一段时间就复发,几乎想要放弃……”
“原本天真地以为不会复发,至少不会短期内复发,然而六个月后就复发了,确切地说是残留肿瘤继续生长。目前术后十个月,医生建议再次手术,真不知如何抉择……”
“2021年首次手术未行放疗,今年复发,此次术后计划联合放疗。希望此次控制时间能更长一些。”“肿瘤再次复发,不知所措,医生不愿再次手术,放疗又恐难以控制,实在令人绝望”……
对脊索瘤患者及其家人来说,“复发”一词极为沉重,它不仅意味着患者需再次承受疾病痛苦,也代表着家庭将面临巨大的心理与经济压力。
Sebastien Froelich教授(福教授)在中国行期间,曾为一例多次复发、高难度的颅底脊索瘤患者完成示范手术,此为患者的第4次手术。
在近四年内,该患者于多家医院接受三次肿瘤切除手术(包括两次经鼻内镜和一次开颅),一次脑积水分流术,肿瘤再次复发且症状加重。经多学科团队“接力”协作,医护人员争分夺秒,福教授成功完成手术,实现肿瘤近全切。
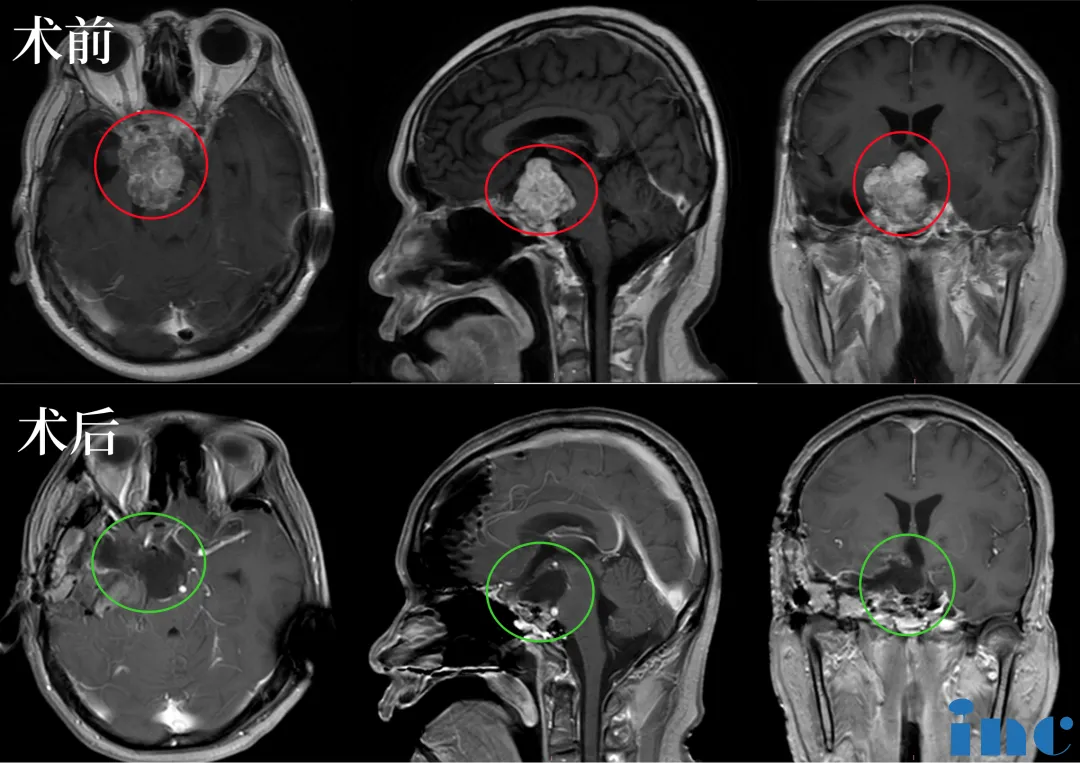
术后情况显示:手术过程顺利,术中将鞍上鞍内区、海绵窦区及三脑室肿瘤予以切除。
INC福教授解读脊索瘤为何罕见且治疗复杂?
脊索瘤治疗之所以具有挑战性,主要源于其侵袭特性。脊索瘤常侵犯骨质,范围常远超MRI影像所见,并可延伸至硬脑膜层间与结缔组织层间。若要实现100%切除,切除范围需超出肉眼可见边界。然而对脊索瘤患者而言,这种可能性极低。
该类肿瘤通常质地坚硬,与骨质紧密粘连,并侵犯重要神经血管组织,因此切除极具挑战性,常需多种手术入路。复杂的解剖结构使得诊断与手术均非常困难,术后易复发,至今仍是神经外科领域的难题。此外,脊索瘤还可发生远处转移,引发局部症状,转移概率介于4%至43%之间,常见转移部位包括淋巴结、中轴骨、肺和皮肤。尽管大部分脊索瘤在病理上属低度恶性,但其高度浸润性的生长方式及原发部位的复杂性,共同导致手术难度极大。
福教授指出,无论是PFS(无进展生存期)还是OS(总生存期),均与既往研究结果一致,切除范围对患者至关重要。事实上,切除范围是颅底脊索瘤一个非常重要的预后影响因素。
切除范围的大小显著影响脊索瘤复发时间。若切除范围过小,肿瘤可能较快复发,甚至约三个月即恢复至术前大小;而若在安全前提下尽可能切除肿瘤,则患者复发速度较慢。以下为福教授为一位男性斜坡脊索瘤患者实施手术的案例,因实现极高切除率,患者术后五年未复发。
一位33岁男性患者确诊斜坡脊索瘤,拒绝开颅手术,最终接受神经内镜微创经鼻手术。手术达成高切除率,至今术后五年患者健康正常生活,复查未见脊索瘤复发或生长。
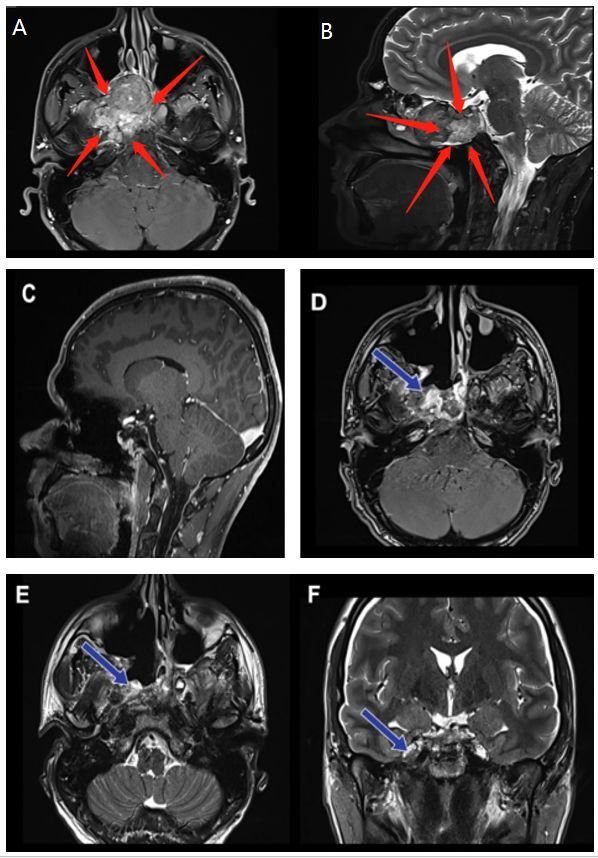
术前影像(红色箭头):图A、B显示右海绵窦中心脊索瘤病灶,病变集中于右海绵窦与翼骨区域,右侧邻接卵圆孔。
手术方式:神经内镜单鼻孔经蝶窦手术切除
术后影像(蓝色箭头):图C矢状位显示无肿瘤残留;图D、E、F轴位与冠状位显示脊索瘤被绝大部分切除。
目前共识认为脊索瘤的一线治疗为外科手术,初始治疗中肿瘤的切除程度对预后极为关键。共识推荐所有颅底脊索瘤术后均应接受辅助放疗。不论发生于何部位,手术质量均为影响脊索瘤患者预后的关键因素(IV级证据,C级推荐)。
福教授表示:我们已经明确,切除范围对患者至关重要,这可能是脊索瘤最重要的预后因素之一。因该类肿瘤复发率极高,手术目标应为全切。当患者出现症状时,多数脊索瘤已较大(超过3-5cm),并常包绕周围多种结构,包括脑血管系统、颅神经和脑干。替代治疗方案是在安全前提下尽可能切除肿瘤,再按计划结合术后放疗。
多项国内外研究显示,脊索瘤切除程度与患者生存率呈高度正相关。因此,尽管手术困难,全球神经外科医生均致力于运用各种精准显微手术技术和神经内镜技术,以实现最大程度切除,从而降低复发风险、延长生存期。
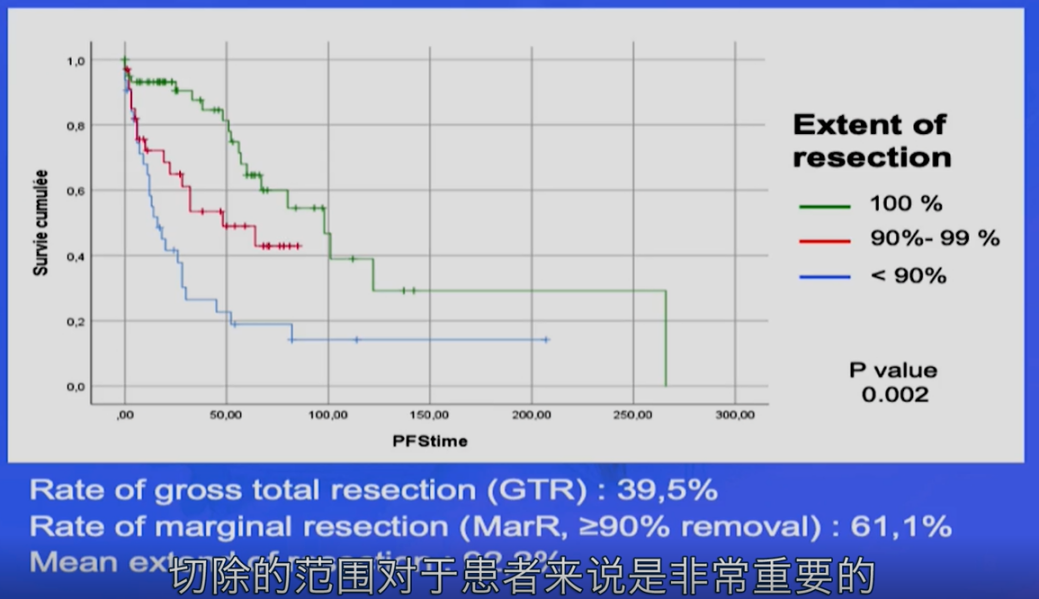
(切除率越高,无进展生存期越长)
脊索瘤手术切除程度分级标准:基于美国癌症联合委员会/国际抗癌同盟(AJCC/UICC)的残留肿瘤分级,CF共识进一步提出脊索瘤切除边缘的三级标准:
RO级:显微镜下瘤周≥1mm组织内无肿瘤;
R1级:仅显微镜下可见瘤周残留(<1mm),肉眼无残留;
R2级:肉眼可见肿瘤块状或散在残留。
对颅底脊索瘤,实现RO级切除极为困难。若达到RO级切除,预期五年无复发生存率可超过50%(IV级证据,B级推荐)。
影响切除范围的因素包括肿瘤是否发生硬膜内扩展及是否包绕重要血管。若肿瘤向硬膜内转移,可切除范围更低,手术更危险且操作更困难。血管包绕情况也非常关键,若肿瘤包绕基底动脉或进入海绵窦与颈内动脉关键部位,则完全切除极为困难。

硬膜内扩展:总生存率87.4%(有扩展)对比97.2%(无扩展)
血管包绕:总生存率87%(有包绕)对比96%(无包绕)
首次治疗的质量同样至关重要。若患者此前接受过不彻底的治疗,几乎难以取得良好结果或实现治愈。因此福教授强调,脊索瘤的首次治疗应选择具备合适条件的医疗中心。
理想的中心应拥有专门且经验丰富的脊索瘤治疗团队,能从最初就对患者进行规范治疗,而非待首次失败后再予重视。同时,专家共识也推荐应在具备丰富颅底外科经验的多学科会诊中心进行治疗(V级证据,A级推荐)。
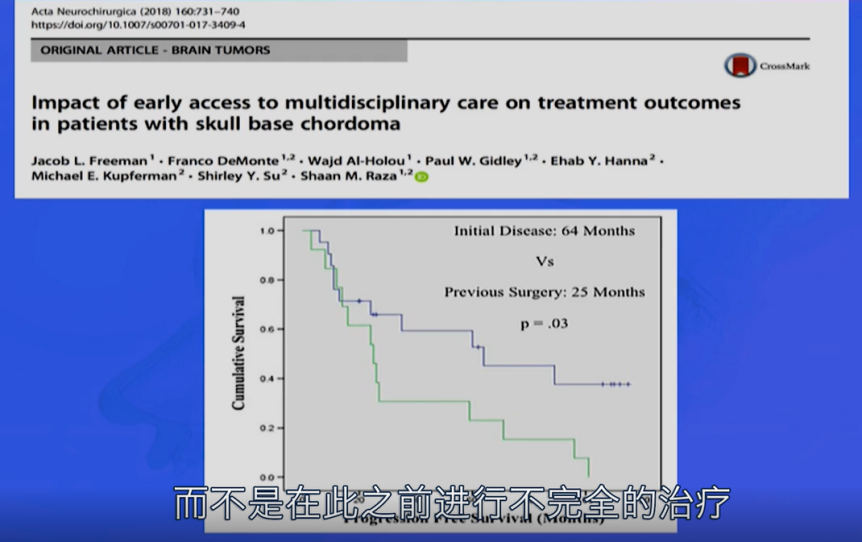
插图:早期多学科治疗对脊索瘤患者影响的论文截图
福教授研究数据显示,68%的患者在转诊至他所在医院前已接受过手术,其中经历过鼻内镜手术者更难以再次治疗。因内镜术后再手术颇具挑战,尤其若存在需修补的脑脊液漏或缺乏黏膜瓣时。
放射治疗也为再手术带来困难,手术闭合是一大难题。若患者曾接受放疗,即便使用皮瓣也不总能有效闭合。既往手术史会使再次手术可切除部分大幅减少,因此福教授认为将患者转诊至脊索瘤专病治疗中心对预后非常重要。
因此,如何延长脊索瘤患者生存期、降低复发?福教授着重指出:脊索瘤患者选择一个协作高效的多学科诊疗(MDT)中心至关重要。应有专门团队负责脊索瘤治疗,能根据病情制定合理治疗方案,从首次治疗就进行系统规划。
此外,合理的MDT多学科治疗显著影响患者预后,术前KPS评分也具有重要性。术后放疗,尤其是质子治疗,可进一步提高患者总生存率。
手术入路选择与颅底外科发展对脊索瘤全切的影响
脊索瘤手术中,入路选择极为关键。选择手术入路时需仔细评估这一生长缓慢的肿瘤及其延伸部位的精确定位,以确保有效且安全的切除。许多患者可能抱有“微创”观念,认为“切口小、不开颅即为微创”,甚至将微创等同于内镜手术。这些实为误解;真正意义上的“微创”应体现为“肿瘤全切、神经功能保全、无严重后遗症”。
福教授认为神经内镜仅是一种工具,对某些适应症效果良好,但并不适用于所有情况。显微镜与内镜技术在复杂颅底疾病治疗中应为互补(complementary)而非竞争(competitive),更非互斥(opposite)关系。将两种技术结合,充分发挥各自优势,可达到治愈疾病、降低手术并发症及死亡率,进而改善患者预后。该理念贯彻于其每一台手术中,对复杂复发脊索瘤,常先在显微镜下切除,再以各种角度内镜观察并清扫残余,即显微镜与神经内镜双镜联合手术。
肿瘤位置方面,颅颈交界区脊索瘤(CCJ)的治疗比典型颈椎脊索瘤更为复杂。由于该区域位置深在且解剖复杂,生长于此的颅底肿瘤切除较为困难,肿瘤可能侵犯周围骨结构,压迫或包绕脑干、椎基底动脉及其分支和多组颅神经,术后易发生颅颈交界区不稳,以及脑干等重要结构损伤,导致肢体瘫痪、呼吸循环衰竭等,手术风险极高。
肿瘤质地也是影响因素之一。质地较软的肿瘤相对更易切除,而质地坚硬或存在明显钙化的肿瘤则会增加切除难度。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号