脊索瘤(图1)是一种良性组织病理学,但表现出侵袭性临床行为并具有侵袭性和转移性潜力的肿瘤。脊索瘤正在挑战肿瘤的治疗,特别是在较佳治疗方面仍有许多问题。在前沿的情况下,复发被延迟,但它是不可避免的10年或20年后。然而,在过去的十年中已经取得了重要的进展。首先,随着颅底内镜入路(EEA)等新技术的进步,手术切除的程度有所提高,由于肿瘤完全切除仍是较重要的预后因素,因此手术切除的重要性大。二,基于更好地了解脊索瘤肿瘤发生的信号通路,正在开发互补的靶向化疗。
脊索瘤在全部原发性骨恶性肿瘤中占1.4%,在全部颅内肿瘤中占0.4%,在脊柱原发性骨肿瘤中占18,190.2%,在脊柱原发性骨肿瘤中占20%和17%,多为C1-C2水平
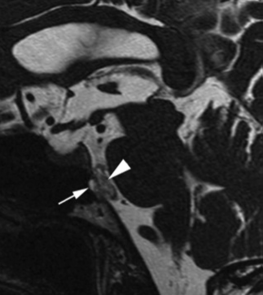
图1:T2 MRI矢状面序列显示一个与斜坡相连的脑桥前颅内脊索瘤(EP)。箭头指示病灶到斜坡的部分。箭头表示脊索瘤位置。
脊索瘤能完全治愈吗?
手术是较合适的治疗,因为完全切除仍然是较重要的预后因素。考虑到脊索瘤和起始骨的中线位置和硬膜外的位置,不穿过脑神经和血管的前路是较合理的,应该被支持。长期采用经口、经蝶和经面途径。如今,EEAs正在取代它们。使用内镜,可以从鞍背(垂体转位)到斜坡的任何部分,甚至到颅颈交界(CCJ)。该入路的外侧界限为静脉结构(海绵窦和颈静脉球)、中枢神经系统和动脉(颈动脉和椎动脉)。然而,现在有经验的团队可以在可接受的风险下到达横向SB,控制并围绕这些血管和中枢神经系统工作。微多普勒和神经导航在这些情况和复发性脊索瘤是强制性的。中枢神经系统的监测,特别是6和12中枢神经系统的监测,也为手术切除带来了顺利。球囊阻塞测试(BOTs)也可能是一个顺利的术前选择,偶尔会导致术前或术中阻塞。内镜技术的一个主要问题是内镜在硬膜内(ID)间隙扩展时的硬膜关闭(作者的128例中超过50%)。复发病例关闭起来更加困难,因为成功关闭的关键鼻中隔可能不再可用。在这些复发中,以前的放疗也增加了脑脊液(CSF)泄漏的风险。如果没有其他闭合的选择,颞顶筋膜瓣可以作为一种救命的选择。尽管较近封堵技术有所改进,术后脑脊液漏的发生率仍在10%左右。
若出现外侧伸长,EEA可在同一或单独阶段合并经颅入路(图2),如Dolenc经海绵入路、颞下入路、前及/或后经骨入路、CCJ前外侧或后外侧入路(远、较外侧)。29.5%的作者采用了两种或两种以上手术方法的联合手术。除了手术切除外,还需要进行颅颈内固定(47例中28例)。无论手术策略是1个或多个入路,还是1个或2个阶段,对患者来说都是一个严重的负担。在作者的系列研究中,没有死亡率和CN缺陷的好转,主要是眼球运动(术前54例,术后11例)和视力缺陷(15例,术后6例)。在CCJ水平上,17例患者术前有CN下段瘫痪(分别为14例、11例和10例CNs IX、X和XI),28例为CN XII。术后,15例患者为下肢CN性瘫痪(分别为15,15,1例CNs IX,X,XI),6例为长期性CN XII性瘫痪。这些低CN缺损需要做14次气管造口和7次胃造口。除此之外,还观察到2例脑卒中(穿孔动脉闭塞)、5例长期性运动障碍、5例新霍纳综合征和16例脑膜炎。
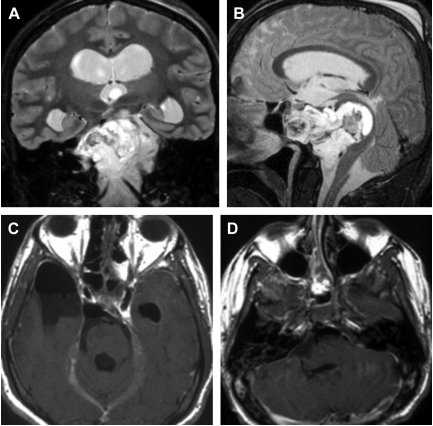
图2:在(A,B)和(C,D)手术切除前(A,B)和(C,D)后(1)颞下入路(2)后外侧入路(3)鼻内镜入路。
脊索瘤的手术策略需是尽可能的根治性切除。36然而,在每个系列中都有大量的继发性患者(在复发或不完全切除后咨询)。在继发性患者中,占36%(见表2),手术难度较大,发病率较高,不完全切除率较高。
相关阅读:脊索瘤两次复发后,如何逃过恶疾再发“魔咒”?【记法国手术之路】
脊索瘤治疗新疗法:靶向治疗
靶向化疗是一种即将到来的治疗模式,基于对脊索瘤肿瘤发生的分子事件理解的前沿进展。转化成肿瘤细胞是由于一系列因子的激活,从细胞表面进入细胞(转导),然后进入细胞核(转录)。细胞表面较重要的因子是酪氨酸激酶受体(RTKs)。到目前为止,已经确认58个RTKs。RTKs被不同的配体激活,主要是生长因子;其中较重要的是血小板衍生生长因子(platelet-derived growth factor,PDGF)、表皮生长因子(epidermal growth factor,EGF)和转化生长因子。这些激活的RTKs依次激活不同的转导因子链。一些较重要的是PI3K,ATK和mTOR;肾素-血管紧张素系统;以及转录的信号转换器和激活剂3。全部这些因素链导致生长和增殖的激活;它们的失调可能是由多种机制引起的,如基因突变(如TSC基因),或RTK配体的过表达。目前,这些因子的几种控制剂可用于治疗肿瘤,特别是脊索瘤。较常用的是PDGF受体控制剂(伊马替尼)或EGF受体控制剂(西妥昔单抗、吉非替尼、埃罗替尼)和mTOR控制剂(西罗莫司)。一些研究已经发表,但它们大多是小系列的脊索瘤复发后其他治疗(手术和放疗)。到目前为止,这种靶向治疗的好处仍然有限,至少有两种主要的解释。一个是激活其他RTK当一个RTK被控制剂阻断;对于mTOR控制的另一种解释是由于上游因素的激活和向另一链因素的偏离而产生的负反馈。总之,这些研究为脊索瘤的治疗带来了很大的希望。此外,一种缓蚀剂已经在体外进行了测试,并取得了良好的效果。未来靶向化疗很可能作为术后辅助治疗或术前新辅助治疗,以缩小肿瘤大小,便于手术切除。
经典化疗对脊索瘤几乎没有影响;然而,重复的直接瘤内注射化疗显示在一段时间内减缓肿瘤进展。
脊索瘤预后
从监测、流行病学和较终结果方案22来看,84%的患者接受了有或没有放疗的手术治疗,13%的患者仅接受放疗,平均生存时间为6.29年;女性比男性(7.25岁vs 5.93岁),SB比MS年龄(6.94岁vs 5.88岁)较长,但不。5年总生存率(OS)为67.6%,10年为39.9%,20年为13.1%。
儿童的预后较好,为48-50,5岁OS为80%,10岁OS为60%。然而,5岁以下儿童的预后更差,2年生存率为30%,因为非典型(或多或少类似于去分化)的非典型(6.6个月生存率为0%)的比例很高(65%)。在梅奥临床系列研究中,50例骶部脊索瘤均为非典型,生存率较短。
转移可能发生,但似乎不影响生存时间。转移发生在全身各处,但常见的是肺、淋巴结、骨骼和皮下组织。平均延迟6年。转移更常在复发后观察到,但可能在诊断时发现或仅在尸检时发现。S组的脊索瘤比SB组更容易转移(73%对9%)。
有三种不同的转移方式。常见的是沿手术路径,是在经蝶入路,经面部入路,或EEA。
另一种播种方式是沿着蛛网膜下腔转移,在ID扩展的脊索瘤中很明显。肿瘤通常沿脊髓生长,特别是在圆锥和马尾处。较后一种播种方法是沿脑室-腹腔分流术;摘要1例经放射治疗及脑室分流治疗的松果体脊索瘤在腹部转移后被诊断。
INC国际神经外科医生集团:虽然脊索瘤治疗已经取得了进展,但它们仍然对治疗损伤和致命肿瘤具有挑战性。位置对预后有的影响,其中CCJ位和颈椎位的预后较SB位差。然而,为了能够根据肿瘤的侵袭性调整治疗策略,仍然需要对每个脊索瘤的生物学行为进行标记。因为切除的范围是影响预后的较佳因素,所以全部的脊索瘤应在初次出现时就进行根治性切除。即使在每一个病例中,特别是在不完全切除的病例中,疗效尚不清楚,但无论切除质量如何,补充质子治疗现在已被常规提出。脊索瘤治疗的未来当然与更好地理解脊索瘤的分子生物学和肿瘤发生有关,因此也与高效靶向化疗的发展有关。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号