INC国际儿童脑瘤专家、世界小儿神经系统知名杂志《Child´s Nervous System》现任主编Concezio Di Rocco教授发表研究《Tis21 Knock-Out Enhances the Frequency of Medulloblastoma in Patched1 Heterozygous Mice by Inhibiting the Cxcl3-Dependent Migration of Cerebellar Neurons》,以下为该项研究的简要介绍。
01 摘要
小脑颗粒神经元前体细胞(GCPs)位于小脑外颗粒层(EGL),其增殖失控可引发髓母细胞瘤。为探究GCPs的肿瘤转化机制,本研究将髓母细胞瘤低发的Patched1杂合子(Patched1+/-)小鼠与Tis21基因缺失小鼠杂交,建立新型髓母细胞瘤模型。Tis21过表达可抑制GCPs增殖并促进其分化,而在人髓母细胞瘤中该基因表达下调。双敲除小鼠的髓母细胞瘤发生率显著上升,并出现由前肿瘤性GCPs所形成的EGL增生性病变。Tis21缺失并不影响GCPs增殖,但可抑制其分化,并显著削弱其离开EGL的内在迁移能力。该迁移障碍可能是肿瘤发生的关键环节:滞留于增殖微环境中的GCPs更易发生转化。通过全基因组分析,我们发现趋化因子Cxcl3为Tis21的直接靶基因。Tis21缺失小鼠的EGL及病变组织中Cxcl3表达下降;外源性补充Cxcl3可挽救Tis21-/- GCPs的迁移缺陷,并显著减小增生病变面积。鉴于Tis21可激活Cxcl3转录,本研究提示Tis21通过Cxcl3诱导GCPs迁移,Cxcl3可能成为髓母细胞瘤治疗的潜在靶点。
02 材料与方法
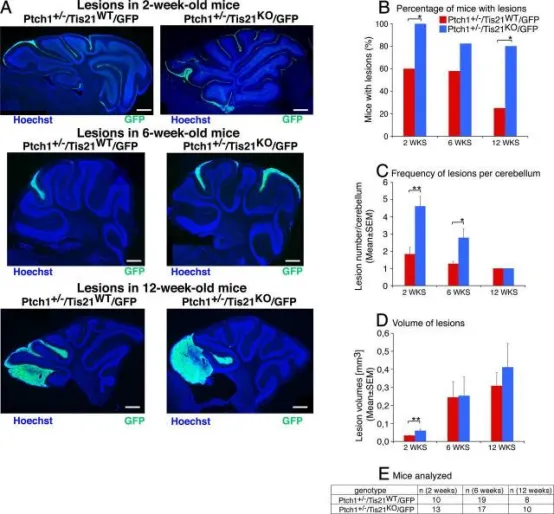
在Patched1杂合背景下敲除Tis21可显著提高发生增生病变的小鼠比例及每侧小脑的病变数量。
A:2、6、12周龄Patched1+/-背景下Tis21野生型(Ptch1+/-Tis21WT/GFP)与Tis21缺失(Ptch1+/-Tis21KO/GFP)小鼠小脑矢状切面的代表性图像。切片经Hoechst 33258染色,通过Math1增强子驱动的GFP标记增殖性(正常及肿瘤性)GCPs以识别病变。标尺为470 μm。
B-D:2、6、12周龄Ptch1+/-Tis21WT/GFP与Ptch1+/-Tis21KO/GFP小鼠中出现病变小鼠的百分比(B)、每侧小脑病变频率(C)及病变体积(D)。
E:B-D分析所使用的小鼠数量。*p<0.05,**p<0.01;B采用χ²检验,C、D采用Student's t检验。误差线表示SEM。
03 研究结果
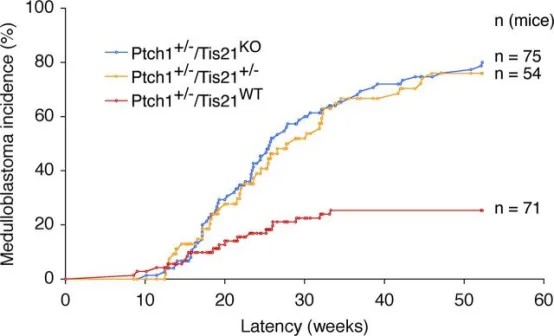
在Tis21同时缺失的Patched1杂合子小鼠中,髓母细胞瘤发生率显著升高。通过将Patched1杂合子与Tis21敲除小鼠回交至少六代,获得Ptch1⁺/⁻/Tis21ᵂᵀ、Ptch1⁺/⁻/Tis21⁺/⁻及Ptch1⁺/⁻/Tis21ᴷᴼ小鼠,并监测其髓母细胞瘤发病情况;与Ptch1⁺/⁻/Tis21ᵂᵀ相比,差异具有统计学意义(p < 0.0001,χ²检验)。
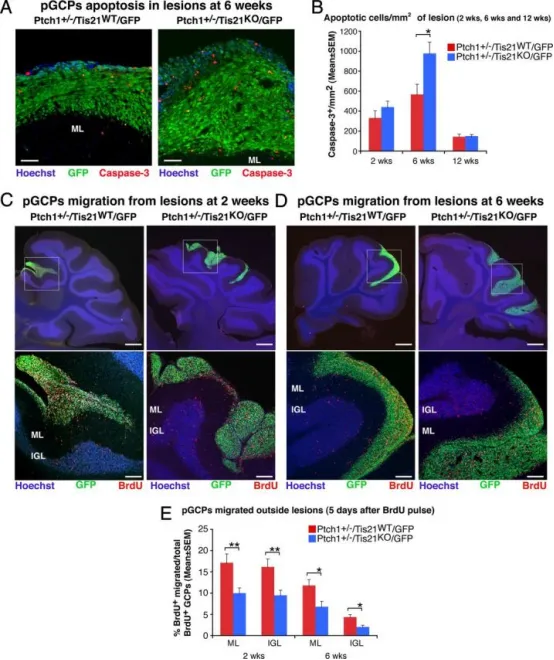
Tis21缺失在Patched1杂合子小鼠中增加前肿瘤性GCP的凋亡并阻碍其迁出病变区:
A 在6周龄Patched1杂合子小鼠中,利用共聚焦显微镜观察前肿瘤性GCP凋亡(以cleaved Caspase-3阳性细胞标记)。Tis21野生型(Ptch1⁺/⁻/Tis21ᵂᵀ/GFP)与Tis21缺失(Ptch1⁺/⁻/Tis21ᴷᴼ/GFP)小鼠的弥散性增生病变中,前肿瘤性GCP为GFP⁺;分子层(ML)及其边界经Hoechst 33258染色显示。标尺为50 μm。
B 以每个病变区GFP⁺区域为界,统计整个病变区内cleaved Caspase-3⁺细胞数,计算为每 mm²的平均值 ± SEM;每只小鼠至少取5张非相邻矢状切片。所用小鼠数量参见图2E。
C、D 在2周或6周龄Patched1杂合子小鼠中,利用BrdU标记迁出病变区的GCP(红色)。Tis21野生型(Ptch1⁺/⁻/Tis21ᵂᵀ/GFP)与Tis21缺失(Ptch1⁺/⁻/Tis21ᴷᴼ/GFP)小鼠的矢状切片用Hoechst 33258复染,显示ML或内颗粒层(IGL)。上方大图框内病变区(标尺410 μm)在下方面板进行高倍放大(标尺100 μm)。
E 以BrdU脉冲后5天计算迁出病变区的GCP比例:将邻近病变区的ML或IGL中BrdU⁺细胞数,除以病变区、ML和IGL内BrdU⁺细胞总数,以百分比 ± SEM表示。2周龄小鼠每基因型3只,6周龄小鼠每基因型至少4只;每只小鼠所有病变均纳入分析。B与E图中*p < 0.05,**p < 0.01,Student's t检验。
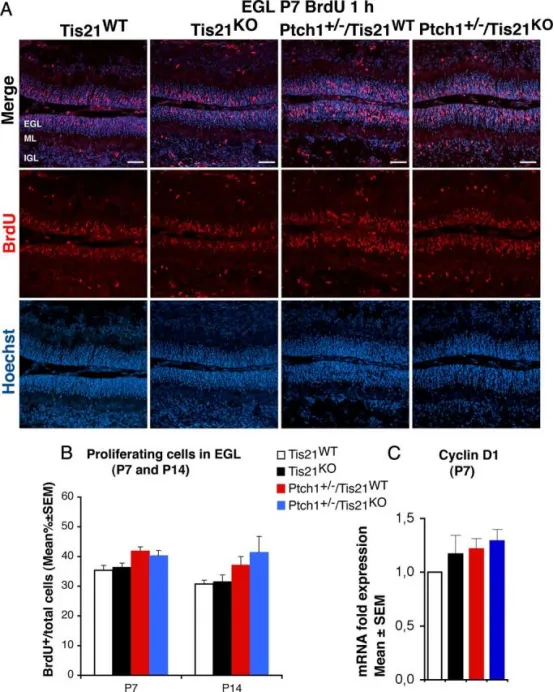
Tis21缺失对Patched1杂合子或野生型小鼠外颗粒层GCPs增殖无影响:
A P7龄四种基因型小鼠外颗粒层(EGL)内GCPs进入S期的代表性共聚焦图像,以1小时短脉冲BrdU标记BrdU⁺细胞;切片用Hoechst 33258复染,标示EGL及其所含颗粒细胞与前体细胞。标尺为50 μm。
B P7及P14龄各基因型小鼠EGL内进入S期的GCPs定量:以BrdU⁺细胞数与Hoechst 33258标记总细胞数之比(BrdU标记指数)表示,数据为平均值 ± SEM。每基因型3只小鼠。
C 实时荧光定量PCR检测P7小鼠分离GCPs的mRNA表达变化,以野生型设为1。数据为3次独立实验的平均值 ± SEM,采用TBP和GAPDH进行归一化。
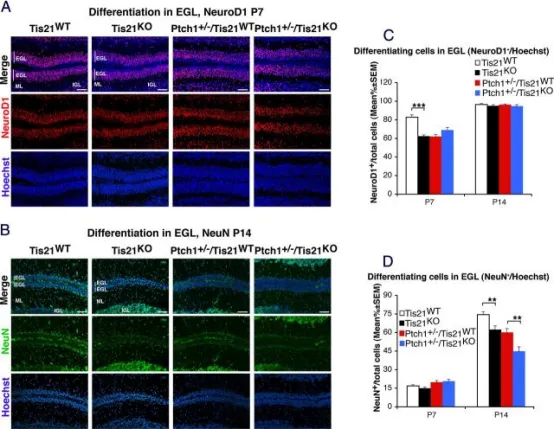
在Patched1杂合子或野生型小鼠中敲除Tis21可抑制外颗粒层(EGL)内颗粒神经元前体细胞(GCPs)的分化:
A、B 代表性共聚焦图像显示四种基因型小鼠EGL内GCPs的分化标志物表达:P7小鼠NeuroD1(A)及P14小鼠NeuN(B)。切片以Hoechst 33258复染,用于显示EGL、分子层(ML)和内颗粒层(IGL)。标尺为50 μm。
C、D 定量分析:在P7和P14小鼠EGL内,分别计算NeuroD1⁺(C)或NeuN⁺(D)细胞数与Hoechst 33258标记总细胞数之比,以平均值 ± SEM表示(每基因型n = 3)。p < 0.01,*p < 0.001,Student's t检验。
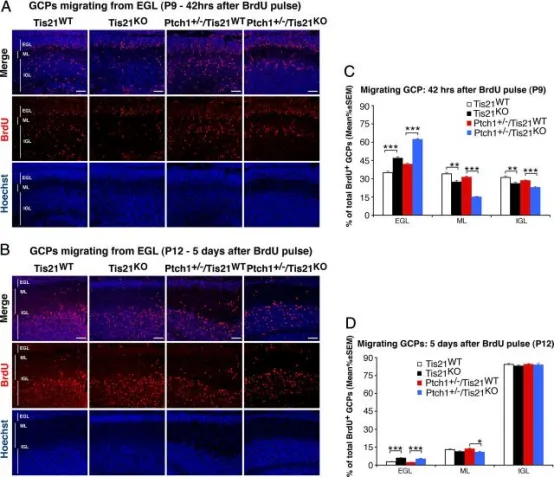
在Patched1杂合或野生型背景下敲除Tis21会损害GCPs从外颗粒层(EGL)向分子层(ML)和内颗粒层(IGL)的迁移:
A、B 典型共聚焦图像显示在P7小鼠注射BrdU后42小时(A)或5天(B)内,Tis21缺失或野生型小鼠(Patched1杂合或野生型背景)中迁出EGL的BrdU⁺ GCPs。切片用Hoechst 33258复染,以显示ML和IGL。标尺为50 μm。
C、D 定量结果:C为P7小鼠注射BrdU后42小时,D为注射后5天,计算EGL、ML或IGL中BrdU⁺细胞占总BrdU⁺细胞的百分比(平均值 ± SEM)。每基因型3只小鼠。p < 0.05,p < 0.01,p < 0.001,Student's t检验。
Tis21缺失小鼠GCP迁出外颗粒层(EGL)障碍可被Tis21在脑片培养中挽救:
A P7小鼠小脑器官型切片代表性共聚焦图,显示BrdU⁺ GCP位于EGL内或已迁出EGL(白虚线标界)。切片经6小时BrdU脉冲标记后,继续培养72小时,固定并以抗BrdU抗体染色。标尺为100 μm。
B BrdU⁺细胞中位于EGL外者所占百分比(平均值 ± SEM,3次实验,每次3只小鼠)。*p < 0.001,Student's t检验。
C 改良Boyden小室检测纯化GCP的内在迁移能力。用FACS从P7小脑分选GFP⁺ GCP,置于上室,计数迁移至膜下侧的GFP⁺细胞。数据为3次独立实验的平均值 ± SEM,每次计数20视野/孔(≥2孔/实验)。Tis21缺失(Patched1野生型或杂合型)GCP迁移数显著低于Tis21野生型。*p < 0.01,Student's t检验。
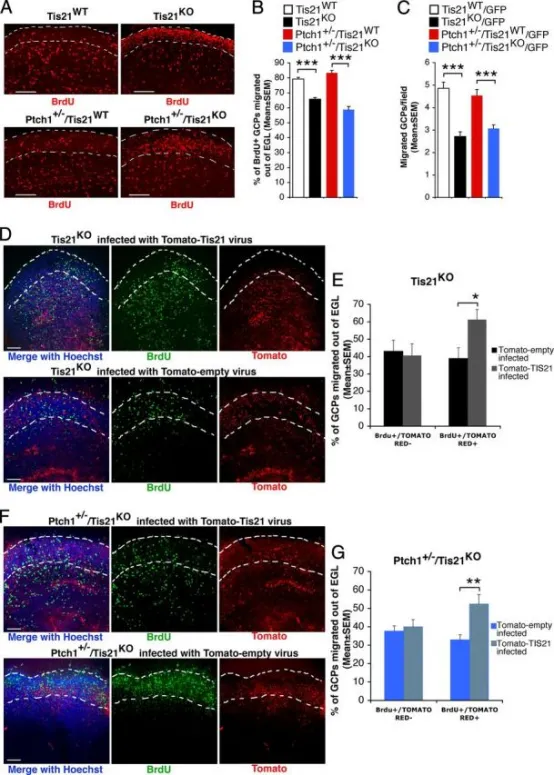
D-G Tis21逆转录病毒在脑片培养中挽救Tis21⁻/⁻ GCP迁移缺陷:
D、F P7 Tis21⁻/⁻(D)或Ptch1⁺/⁻Tis21⁻/⁻(F)小鼠小脑切片感染Tomato-Tis21或Tomato-empty逆转录病毒,6小时BrdU脉冲标记,继续培养72小时,固定并以抗BrdU抗体染色。标尺为100 μm。
E、G 在Tis21⁻/⁻(E)或Ptch1⁺/⁻Tis21⁻/⁻(G)切片中,计算BrdU⁺/Tomato⁺或BrdU⁺/Tomato⁻细胞位于EGL外的百分比,并以总BrdU⁺细胞为分母。BrdU⁺/Tomato⁻细胞无显著变化,证实感染特异性。数据为3次实验平均值 ± SEM,每次3只小鼠。*p < 0.05,**p < 0.01,Student's t检验。
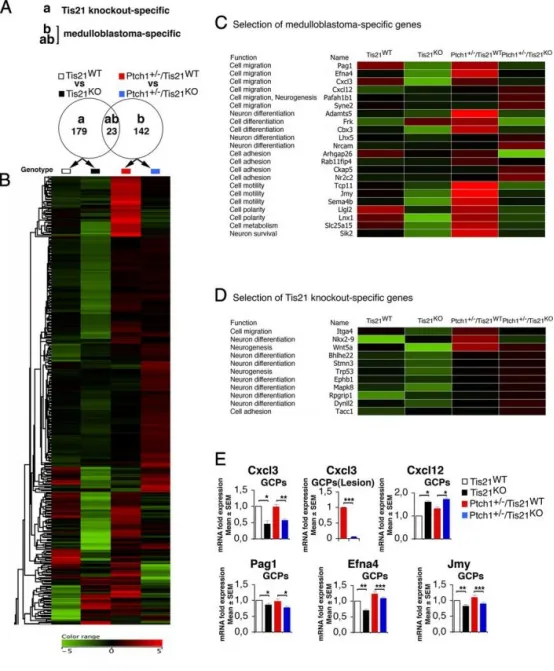
Patched1杂合/Tis21缺失模型中的髓母细胞瘤特异性基因表达:
A 维恩图所示:对P7小鼠GCPs进行芯片分析,仅在与野生型(Tis21ᴷᴼ vs Tis21ᵂᵀ)的比较(a)中鉴定出179个Tis21敲除特异性差异基因;同样,在与Patched1杂合/Tis21野生型(Ptch1⁺/⁻/Tis21ᴷᴼ vs Ptch1⁺/⁻/Tis21ᵂᵀ)的比较(b)中鉴定出165个髓母细胞瘤特异性差异基因;其中23个基因在两项比较中均显著差异。
B 采用层次聚类算法(欧氏距离,质心法)对两项比较中共344个差异表达基因进行排序;颜色表示相对中位数的高(红)到低(绿)表达变化。
C 22个髓母细胞瘤特异性基因参与细胞迁移、分化或黏附过程。
D 11个Tis21敲除特异性基因参与细胞迁移或分化过程。
E 实时PCR验证5个神经元髓母细胞瘤特异性基因在P7 EGL的GCPs或6周龄病变(GFP⁺)中的差异表达,以野生型小鼠设为1;数据为3次独立实验的平均值 ± SEM,以TBP和GAPDH归一化。p < 0.05,p < 0.01,p < 0.001,Student's t检验。
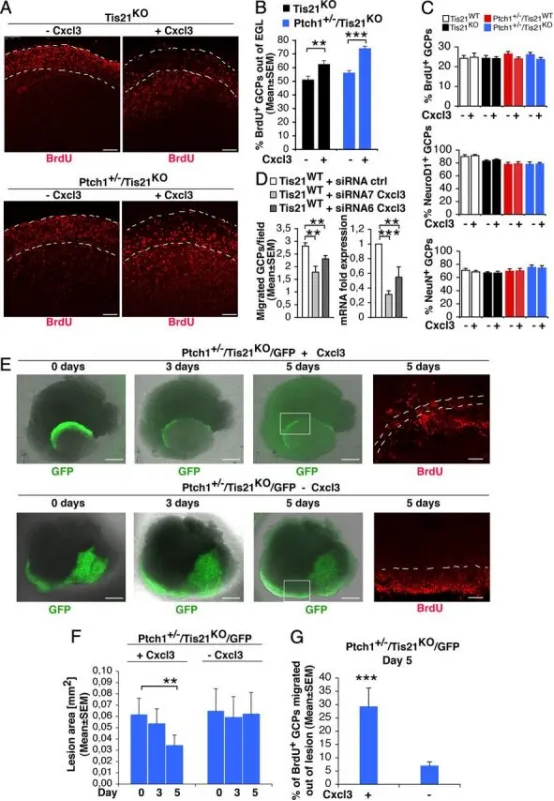
Cxcl3可挽救Patched1杂合/Tis21敲除小鼠GCP迁出EGL或病变区的缺陷,并缩小病变面积:
A Tis21缺失/Patched1野生型或杂合型小鼠小脑器官型切片经±Cxcl3处理后,BrdU⁺ GCP位于EGL内或外(白虚线)的代表性共聚焦图。标尺为100 μm。
B 迁出EGL的BrdU⁺ GCP定量:P7切片经±Cxcl3培养5天(t0加BrdU 18小时),固定后BrdU免疫染色。数据为3次实验(每基因型3只小鼠)BrdU⁺细胞外/总比值的平均值 ± SEM。p < 0.01,*p < 0.001,Student's t检验。
C Cxcl3处理后EGL内增殖(BrdU⁺)或分化(NeuroD1⁺/NeuN⁺)GCP定量:P7切片±Cxcl3培养48小时(分析前2小时加BrdU),固定后BrdU、NeuroD1、NeuN免疫染色。数据为3次实验(每基因型3只小鼠)各标记细胞占总数百分比的平均值 ± SEM。
D Cxcl3 RNAi抑制GCP迁移(左图)。野生型P7大鼠纯化GCP电转siRNA7-Cxcl3、siRNA6-Cxcl3或对照siRNA,恢复3小时后置于改良Boyden小室上室,16小时后计数迁移细胞。数据为3次独立实验(每实验20视野/孔,≥2孔)的平均细胞数/视野 ± SEM。右图为相同细胞Cxcl3 mRNA水平(TBP归一化)。p < 0.01,*p < 0.001,Student's t检验。
E 4周龄Patched1杂合/Tis21缺失(Ptch1⁺/⁻/Tis21ᴷᴼ/GFP)小鼠脑片±Cxcl3处理后,弥漫性增生病变GFP⁺ GCP(绿)及BrdU⁺ GCP(红)迁出病变区(白虚线)的代表性图。标尺:GFP 500 μm,BrdU 100 μm。
F 病变面积(F)及迁出病变区的BrdU⁺ GCP百分比(G)定量:P42切片±Cxcl3处理5天(t0加BrdU 18小时),固定后BrdU免疫染色。数据为3次实验(每基因型3只小鼠)的平均值 ± SEM。p < 0.01,*p < 0.001,Student's t检验。
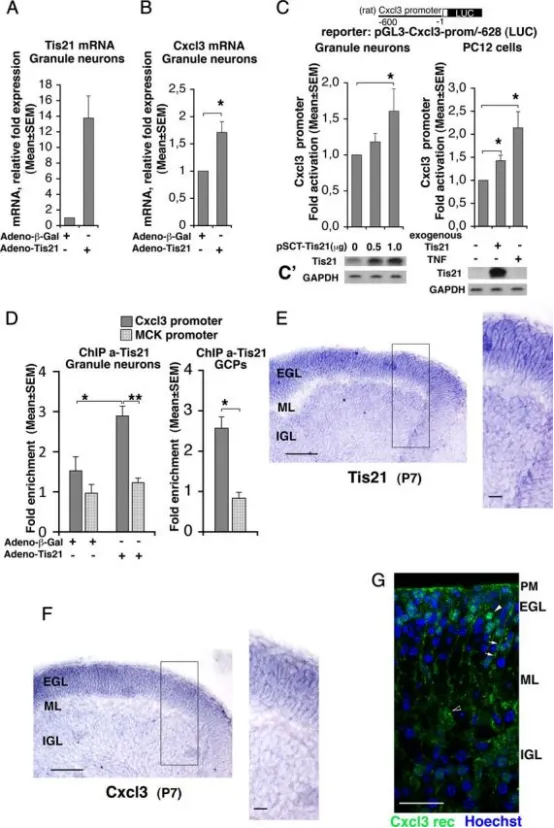
Tis21与Cxcl3启动子结合并诱导Cxcl3转录:
A、B:实时RT-PCR检测小脑颗粒神经元原代培养中Tis21与Cxcl3 mRNA的表达。细胞取自P7大鼠,种植当日(DIV 0)即感染重组腺病毒adeno-Tis21或对照adeno-β-Gal,24小时后收集。所用引物(大鼠序列)可同时检测内源和外源Tis21 mRNA。数据为5次独立实验的均值 ± SEM,内参为TATA结合蛋白mRNA。*p < 0.05 vs 对照,Student's t检验(在以内参归一化、尚未计算为相对表达倍数的数据上进行)。
C:在P7野生型大鼠小脑颗粒神经元中转染Tis21表达质粒(pSCT-Tis21),以及在可诱导表达Tis21(大鼠序列)的PC12细胞中,Cxcl3启动子活性均显著高于仅表达内源Tis21的对照。Cxcl3启动子构建体包含转录起始位点5′端上游628 nt,克隆于荧光素酶报告基因上游(构建体pGL3-Cxcl3-prom/-628)。TNF-α作为已知Cxcl3启动子诱导剂,在PC12细胞中用作阳性对照。荧光素酶活性以相对对照的倍数表示,数据为5次实验的均值 ± SEM。*p < 0.05 vs 无外源/异位Tis21的对应对照,Student's t检验。
C′:平行培养物以Western blot检测Tis21蛋白表达。
D:染色质免疫共沉淀(ChIP)检测Tis21与Cxcl3启动子及肌酸激酶启动子(MCK,阴性对照)的结合。实验对象:左侧柱状图所示为按A、B条件感染adeno-Tis21或adeno-β-Gal的小脑颗粒神经元;右侧柱状图所示为P7野生型大鼠小脑前体细胞(GCPs)。使用抗Tis21抗体A3H进行免疫沉淀,所得Cxcl3或MCK启动子片段量以实时PCR定量,并以富集倍数表示(Tis21免疫沉淀所得启动子百分比与正常血清对照之比)。Tis21蛋白与Cxcl3启动子的结合(深灰色柱)显著高于基线水平(即与阴性对照MCK启动子的结合水平),且与Tis21 mRNA的过表达正相关(参见A)。数据为小脑颗粒神经元5次、GCPs 3次独立实验的均值 ± SEM。*p < 0.05 vs 对照,Student's t检验。
E、F:P7野生型小鼠小脑矢状切片原位杂交显示Tis21与Cxcl3 mRNA表达,二者在整个外颗粒层(EGL)宽度内共定位且表达极高。黑框示高倍区域。标尺:100 μm;放大图20 μm。
G:Cxcl3受体Cxcr2的免疫染色(特异性抗体)在P7野生型小鼠小脑矢状切片的代表性共聚焦图像。细胞核以Hoechst 33258标记。Cxcr2受体簇在GCPs(EGL内白色箭头)明显可见,软脑膜(PM)及浦肯野细胞(黑白箭头)亦有较低表达;白色箭头指示疑似Bergmann胶质细胞。标尺25 μm。
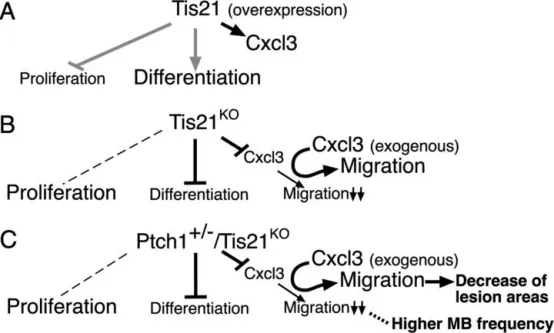
工作模型:在Tis21功能获得(A)或Tis21功能缺失(B:Ptch1+/+背景;C:Ptch1+/−背景)条件下,图示均以GCPs为对象,描述其增殖、分化以及离开外颗粒层(EGL)的迁移。A中灰色线表示来自既往文献的数据(Canzoniere等,2004;Farioli-Vecchioli等,2007)。B、C:在Tis21KO及Ptch1+/−/Tis21KO小鼠中,GCPs的Cxcl3表达减少,且GCPs迁出EGL的能力下降。C:在Ptch1+/−/Tis21KO小鼠中,上述下降与髓母细胞瘤发生率增高相关(虚线)。两种基因型中,外源性Cxcl3均可挽救迁移缺陷;在Ptch1+/−/Tis21KO小鼠中,Cxcl3还能减小小脑病变面积(C)。左侧虚线表示对增殖无显著影响(与对照相比)。
04 关于作者
小儿神经外科专注于处理儿童各类神经外科疾病,如脑肿瘤、脑积水、小儿癫痫、先天畸形等,一直被视为外科领域中难度较高的专业之一。Concezio Di Rocco教授曾接受法国、埃及、吉尔吉斯斯坦等国家的邀请进行专题讲座和手术演示,并联合全球知名小儿神经外科专家创办了儿童神经外科研究所课程。该课程在过去30年间为全球培养了众多儿童神经外科医生,包括目前国内若干知名三甲医院的儿童神经外科主任专家,均曾受教于他。Concezio Di Rocco教授将其领先的治疗技术分享给世界各地儿科神经外科医生参考和学习,为世界儿科神经外科的发展做出了重要贡献。Di Rocco教授曾到访苏州大学附属儿童医院,为6名神经外科疑难杂症孤儿进行义诊。

Di Rocco教授曾撰写或参与撰写的部分儿童神经外科著作,并担任以下职务:
国际儿童神经外科学会主席(ISPN)(1991-1994年)
世界神经外科联合会教育委员共同主席(2013-2017年)
世界神经外科联合会儿童神经外科委员会主席(2001-2009年)
世界小儿神经系统知名杂志《Child´s Nervous System》现任主编
国际儿童颅底学会主席(创始成员)
世界神经外科联合会基金小儿脑积水项目负责人
德国汉诺威国际神经科学研究所儿科神经外科主任(2013年至今)
欧洲神经外科学会(EANS)前副主席
世界神经外科学会联合会(WFNS)儿科委员会曾任主席
罗马天主教大学医学院儿科神经外科学系主任

国际儿童神经外科专家 Concezio Di Rocco教授
自2014年5月起,Di Rocco教授担任德国汉诺威国际神经科学研究所(INI)的儿科神经外科主任。从事儿童神经外科事业50余年,Di Rocco教授尤其擅长小儿神经纤维瘤、癫痫、脑积水、蛛网膜囊肿、颅缝早闭、脑和脊髓肿瘤、脑和脊柱畸形(半椎体畸形,皮质发育不良,脊髓脊膜膨出,脊髓内脂肪瘤,Arnold-Chiari畸形等)难治病症的治疗,曾完成超过12000例神经外科手术。


 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号