高级别胶质瘤患者通常表现为在数日至数周内进展的亚急性神经系统症状和体征,具体表现因肿瘤在脑内的位置而异。脑部MRI可以提供占位性病变的确证,但是较终需要组织学诊断以区分高级别胶质瘤与其他原发性和转移性脑肿瘤。高级别胶质瘤早期症状有哪些?
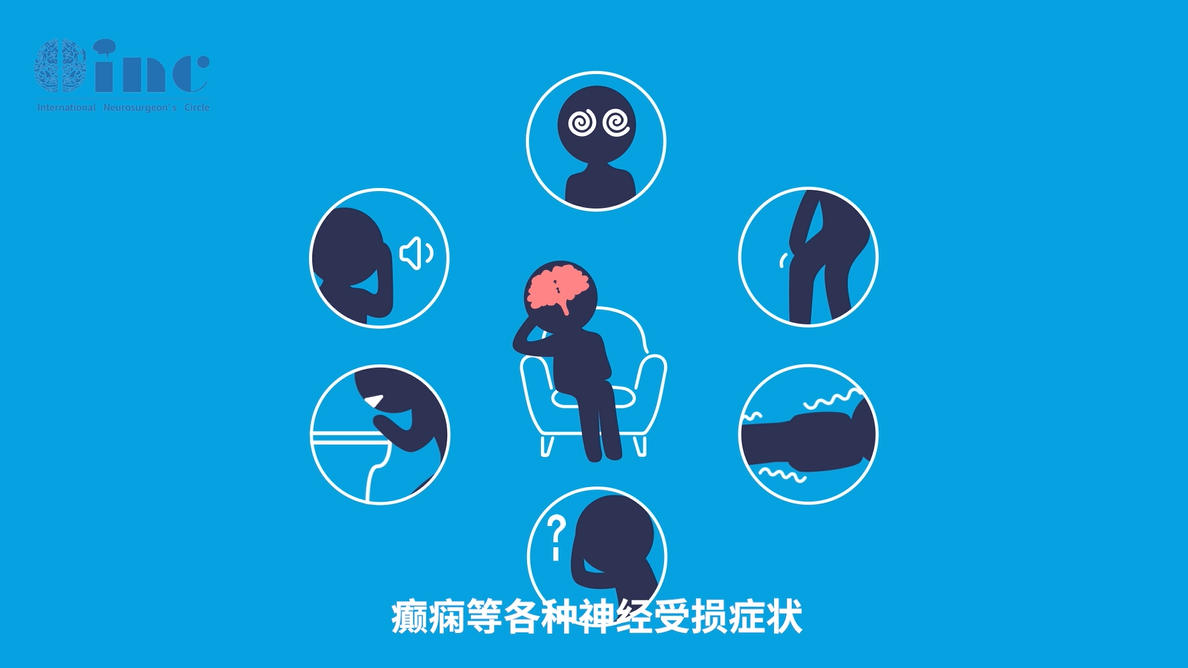
主诉症状和体征
高级别胶质瘤的主诉症状和体征取决于病变的位置和大小,与其他原发性和转移性脑肿瘤引起的症状和体征相似。患者通常表现为在数日至数周内进展的进行性神经系统症状。
在高级别胶质瘤患者中,较常见的主诉症状包括:
●头痛(50%-60%)
●癫痫发作(20%-50%)
●局灶性神经系统症状,如记忆丧失、运动肌无力、视觉症状、语言缺陷、认知和人格改变(10%-40%)
胶质母细胞瘤比低级别胶质瘤更常伴局灶性神经系统缺陷,而前者以癫痫发作为主诉症状的几率低于后者。大肿瘤可能导致明显水肿、占位效应和颅内压增高。
少数情况下,高级别胶质瘤可出现脑膜播散,这种表现更多是在疾病自然病程后期或尸检时才能诊断。脑膜胶质瘤病的主诉症状有背痛(伴或不伴神经根症状)、神志改变、脑神经麻痹、脊髓病变、马尾综合征、头痛及有症状的脑积水。
家族史和危险因素
多数高级别胶质瘤患者没有脑肿瘤家族史或可识别的胶质瘤危险因素。
少数情况下,胶质母细胞瘤和其他高级别胶质瘤是肿瘤易感综合征的表现,包括Li-Fraumeni综合征、Lynch综合征(遗传性非息肉病性结直肠癌)或结构性错配修复缺陷综合征。这些病例大多有家族史,即有多名一级和二级亲属患早发型癌症。通常将此类患者咨询进行遗传咨询。对于看似散发性的高级别胶质瘤,以及有脑肿瘤聚集性发病但未发现遗传综合征的家族,其遗传因素知之甚少。
除了遗传因素,胶质母细胞瘤和其他高级别胶质瘤的明确危险因素是电离辐射暴露,例如因儿童期脑肿瘤或白血病而接受放疗。从辐射暴露到发生胶质瘤的潜伏期从5年到几十年不等。关于电磁辐射、手机射频辐射和头部创伤等其他环境暴露的数据尚无定论。
神经影像学
增强MRI能比CT更好地显示脑肿瘤的特点。
在MRI上,高级别胶质瘤在T1加权像通常呈低信号,使用造影剂后呈不均匀强化。胶质母细胞瘤通常表现为边缘呈致密强化,而中央区域不强化,提示坏死。T1加权序列上强化肿瘤能与瘤周水肿的低信号相区别。不管组织学分级如何,高级别胶质瘤通常显示T2液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)序列信号强度增加,但一些间变性胶质瘤并不显示出对比强化。
许多间变性胶质瘤和部分胶质母细胞瘤的特征为可能呈多灶性的浸润性非增强肿瘤区域。浸润性肿瘤通常表现为同时累及皮质和其下方白质的膨胀性T2高信号异常。此类区域可能与肿瘤增强区域相连,也可能不相连。间变性少突胶质细胞瘤可能存在内部钙化区域。
在磁共振波谱分析(magnetic resonance spectroscopy,MRS)中,高级别胶质瘤通常以胆碱增加和N-乙酰天冬氨酸减少为特征。磁共振灌注成像常显示出血流量增加的证据。与其他恶性肿瘤一样,高级别胶质瘤的代谢活动增加,PET通常显示氟脱氧葡萄糖摄取增加。
诊断性评估
对于疑似高级别胶质瘤患者,应采集病史并进行体格检查,以评估是否存在肿瘤相关症状及神经功能障碍。根据功能障碍的程度和患者的临床稳定性确定神经外科评估和治疗的紧迫性以及对皮质类固醇的需求。
术前通常只需行脑部增强MRI。有脑部MRI禁忌证的患者应行头部增强CT。若根据临床及影像学表现高度怀疑为高级别胶质瘤,则没有必要行系统性恶性肿瘤筛查。
对于出现癫痫发作或病史提示有既往未报告或未识别癫痫发作的患者,应予以抗癫痫发作药治疗。从未出现癫痫发作的患者在围手术期之外无需预防性使用抗癫痫发作药。
组织学诊断对推定诊断为高级别胶质瘤的患者至关重要,可在手术切除或单行活检时完成。以下情况单行活检:病变不适合行切除术;无法切除有意义的肿瘤组织量;患者的总体临床状况不允许手术。在其余病例中,较大限度顺利切除肿瘤是诊断和治疗的优选初始方法。手术患者应在术后24-48小时内重查脑部MRI以确定切除程度。
病理学
根据2016版WHO分类,胶质瘤的分类不仅是基于组织病理学表现,还基于分子参数,包括异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变状态和是否存在1p/19q联合缺失。根据生长模式、行为和共同的IDH基因状态,星形细胞肿瘤和少突胶质细胞肿瘤均归类为弥漫性胶质瘤。
组织病理学—星形细胞肿瘤由具有以下特征的细胞构成:细胞核细长或不规则,深染;细胞质呈嗜酸性、胶质原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)阳性。而少突神经胶质瘤的细胞核呈圆形,常伴有核周空晕、钙化和纤细的分支血管。随着组织学分级增加,肿瘤会有其他恶性肿瘤特征。一般而言,核异型性和有丝分裂活性增加是Ⅲ级间变性肿瘤的特征,而微血管增生和坏死是Ⅳ级胶质母细胞瘤的特征。
关键的分子检测技术——对诊断、预后及治疗至关重要
明确胶质瘤的分子特征对准确诊断、判断预后和治疗越来越重要。高级别胶质瘤样本的常规病理学评估应包括IDH突变检测,对某些患者还包括1p/19q联合缺失检测以做出整合诊断。
针对胶质瘤较常见IDH突变IDH1 R132H的免疫组织化学(immunohistochemistry,IHC)检测可检出胶质瘤中90%左右的IDH突变。若IDH1 R132H突变IHC检测呈阴性,则应优先对全部Ⅲ级胶质瘤患者和较年轻(<55岁)的胶质母细胞瘤患者行IDH1和IDH2测序,因为IDH突变型与野生型肿瘤的区分会影响预后判断,也是整合诊断的关键。55岁以上的胶质母细胞瘤患者无需行IDH测序,因为目前认为IDH突变在该年龄段胶质母细胞瘤患者中少见。
全部具有少突胶质细胞瘤组织病理学特征的肿瘤均需行1p/19q联合缺失检测。对Ⅱ级和Ⅲ级(间变性)少突胶质细胞瘤进行整合诊断,需确证存在1p/19q联合缺失以及IDH1或IDH2突变。
若胶质母细胞瘤的样本量足够,则还应检测O6-甲基鸟嘌呤DNA甲基转移酶(MGMT)启动子甲基化状态。虽然该检测不是诊断所需的,但其结果有助于判断预后且能评估患者对烷化剂化疗的反应。
整合诊断—2016版WHO分类系统根据组织病理学和分子特征对成人弥漫性胶质瘤进行分类。目前将弥漫性胶质瘤细分为IDH突变型肿瘤和IDH野生型肿瘤,每种类型均包含基于组织病理学特征的多种分级。较常见的高级别胶质瘤包括:
●IDH野生型胶质母细胞瘤
●IDH突变型胶质母细胞瘤
●IDH野生型间变性星形细胞瘤
●IDH突变型间变性星形细胞瘤
●IDH突变伴1p/19q联合缺失型间变性少突胶质细胞瘤
对于特征完全明确的肿瘤,不再有“间变性少突星形细胞瘤”这一诊断。对于具有混合组织学特征的肿瘤,需同时了解IDH和1p/19q联合缺失状态,以根据分子标签将其分类为星形胶质细胞瘤或少突神经胶质瘤。
肿瘤基因组测序的作用
针对癌症样本的二代测序技术的价格已更加亲民,也更为普及,但对胶质瘤样本行常规测序尚未证实有临床益处。
针对胶质瘤样本的基因检测通常包括筛查较常见的癌症基因,其中部分基因(如BRAF V600E)偶尔见于胶质母细胞瘤,这种基因检测可能使患者有机会参与相关靶向药物的临床试验。筛查致癌基因融合也可识别相关靶点,包括神经营养性受体酪氨酸激酶(NTRK)基因融合或成纤维细胞生长因子受体3-转化酸性含卷曲螺旋蛋白3(FGFR3-TACC3)基因融合等。
一旦确诊高级别胶质瘤怎么办?
对于高级别胶质瘤患者,建议在保留神经功能的情况下进行较大范围的手术切除,而不是活检。尽管优选全切除,但根据肿瘤的位置和范围,仅仅进行次全切除或活检可能也是需要的手段。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号