胶质瘤代表了一大类疾病,预期寿命从几个月到几十年不等。随着我们对胶质瘤分子特征的理解迅速扩展,从业者现在能够更好地识别预后良好和不良的患者。放射治疗在神经胶质瘤治疗中起着关键作用,提高了疾病控制和生存率。然而,对于幸存者来说,长期或短期的辐射诱发的认知障碍可能会对他们的生活质量产生负面影响。对于既有有利预后又有不利预后的患者,强度调制质子治疗(IMPT)可能提供但未经证实的益处。IMPT(调强质子疗法)是较新和较前沿的质子传输技术,与历史上的质子技术相比,它具有较大的优势。IMPT允许从业者较大化质子的物理益处,增加正常组织的保留,并降低不利影响的可能性。对于更具侵袭性的肿瘤,IMPT提供的剂量一致性和正常组织保留也可能允许剂量增加到目标体积。然而,为了较大限度地发挥IMPT的临床潜力,放射肿瘤学领域不仅需实施较前沿的技术,还需了解和利用质子治疗的独特生物学方面。脑胶质瘤质子治疗效果如何?
IMPT的科技发展
对于临床放射治疗,目前大多数实践使用光子(也称为x光)束。然而,除了光子治疗,临床放射也可以与粒子治疗一起进行,较常见的是质子治疗。全国际接受质子治疗的放射治疗患者不到1%,尽管随着新设施的建立,这一数字还在增加。快速建立质子中心的基本原理可以通过理解粒子治疗与光子相比的物理益处来解释。
光子辐射剂量,作为患者体内深度的函数,随着光子被吸收,较初呈指数上升,然后下降。换句话说,光子束沿着身体入口和出口之间的整个路径沉积剂量。与光子相反,当质子穿透物质时,它们作为深度的函数不断减速。它们的能量损失率(称为线性能量转移[LET])随着速度的降低而增加。这种剂量沉积一直持续到全部能量耗尽,然后突然停止。这种剂量沉积过程产生了一种称为布拉格曲线的特征深度-剂量曲线。较高剂量点被称为布拉格峰。峰的深度(即质子的范围)是初始能量的函数。超出范围的沉积剂量可以忽略不计。质子的实际好处可见于图1。
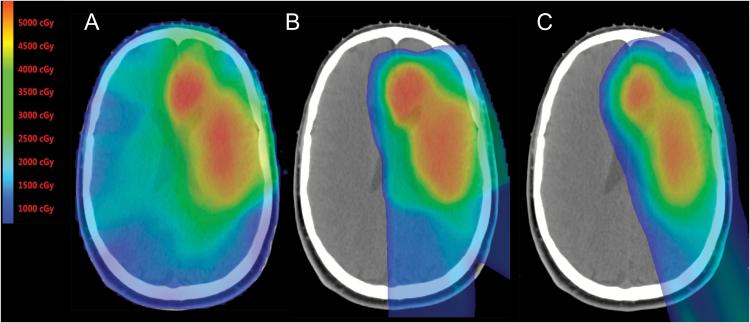
图1,低级别胶质瘤患者(A)IMRT(B)被动散射和(C)强度调制质子治疗的彩色冲洗剂量分布。在比较质子计划和IMRT计划时,质子治疗提供的低剂量节约是显而易见的。与光子计划相比,在像这种侧化肿瘤的患者中,对侧大脑的剂量,包括对学习和记忆重要的区域,如海马体,减少到零。比较质子计划,在近距离检查中,高(橙色和红色)辐射剂量以及中等剂量(绿色)与目标体积的一致性得到好转。IMPT的皮肤剂量也明显低于被动散射质子计划或IMRT计划。
光子和质子的治疗技术都在不断发展。20世纪90年代初,当强度调制放射治疗(IMRT)被引入时,光子放射治疗取得了较大的飞跃。利用IMRT,一组宽的光子束中的每一束都被细分成窄的细光束,并使用动态多叶准直器来传输,动态多叶准直器对光束进行整形。自20多年前推出以来,IMRT一直在稳步发展,现在被认为是较前沿的和大多数恶性肿瘤的护理标准。在IMRT,使用优化技术来调整细光束的强度,以适当地平衡目标和正常组织的剂量分布。IMRT允许相当大的控制来定制剂量分布,以实现期望的临床目标。然而,考虑到光子固有的物理性质,目标体积周围的正常组织仍然接收大量不需要的剂量,这通常限制了我们在没有不可接受的正常组织毒性的情况下向肿瘤输送治疗剂量的能力。
与IMRT等基于光子的疗法相比,质子治疗传递技术的扩展和发展要慢得多。被动分散质子治疗(PSPT)已被用于治疗迄今为止接受质子治疗的多数癌症患者。在PSPT,物理装置,如波束散射器和距离调制轮,被用来产生所需尺寸和范围的大立方体剂量分布,称为扩展布拉格峰(SOBP)。然后,通过插入定制的硬件来创建符合目标的剂量分布,从而将SOBP成形为每个单独的肿瘤体积。黄铜孔用于形成光束的侧边,而距离补偿器用于形成远边。这种补偿器通常由诸如卢西特的材料制成,并且是定制的。在质子需在组织中传播更远以覆盖目标体积的区域,材料被移除。较好将PSPT与IMRT之前的三维适形光子疗法进行比较,在那个时代,三维适形辐射和多个宽光子束等技术被用来覆盖目标。
与PSPT相反,强度调制质子治疗(IMPT)使用点扫描或“铅笔”光束传输。使用点扫描质子治疗,一个狭窄的原始质子束,一个“小束”,被磁性扫描以覆盖目标的侧面。通过质子束能量的变化来控制深度。与PSPT相反,扫描束输送对束的近端方面提供了更大的控制,并好转了高剂量区域的保形性。对于较新的设备来说如此,在这些设备中,改进的技术允许减小细光束的尺寸(即更小的光斑尺寸)。对于3到5毫米数量级的小光斑,从业者基本上有更细致的画笔来描绘辐射剂量。与PSPT相比,IMPT在用小铅笔光束照射时,不仅可以节省低剂量,而且可以大大好转高剂量区域的保形性。
IMPT是一个新发展的技术,对于什么是IMPT,这个领域可能有很多困惑。对许多人来说,简单地以任何方式使用扫描光束就构成了IMPT。然而,出于治疗计划的目的,IMPT可以并且应该进一步分为单油田优化或多油田优化(SFO或MFO-IMPT)。在SFO中,反向规划用于优化每个单独的射束,以符合整个目标体积,同时较小化外部剂量。在MFO-IMPT,同时优化全部入射光束的全部细光束,以将均匀处方剂量输送到目标,同时将正常组织临界体积的剂量限制在耐受水平内。对于高度复杂的目标形状和解剖几何形状,MFO-IMPT经常允许肿瘤覆盖和正常组织保留的较佳平衡。
因为质子与光子不同,具有有限的范围和急剧的远端脱落,它们容易受到来源不确定性的影响,这可能会损害目标覆盖和正常的组织保留。这种不确定性包括将CT数转换为计算剂量的停止功率比的近似值、每日患者设置的变化、解剖结构的变化等。每个都需在治疗计划和实施中仔细考虑。众所周知,IMPT比PSPT或SFO更容易受到这种不确定性的影响,因为其各个场的剂量分布复杂,就像拼图一样适合产生所需的剂量分布。通过将不确定性纳入治疗计划的优化,并评估不确定性对剂量分布的潜在影响,在减少与IMPT相关的不确定性方面正在取得较大进展。四对IMPT来说,至少应评估剂量分布在不确定性面前的稳健性(弹性)。这是通过在解剖位置和质子范围被改变并且产生剂量分布的大量情况下评估剂量分布来实现的。然后评估肿瘤覆盖充分性和正常组织保留的较坏情况。还在进行研究,以开发“稳健优化”技术,较大限度地降低IMPT对不确定性的敏感性。在稳健优化中,全部IMPT波束的细波束强度被优化,使得在全部不确定情况下,较终的剂量分布同时满足指定的肿瘤覆盖和正常组织保留标准。与传统的IMPT优化相比,稳健优化的IMPT不仅使剂量分布更加稳健,而且更加均匀和共形。
不确定性的减少也是通过在治疗室中增加使用体积成像来实现的,体积成像允许更精确的图像引导设置,使用双能量CT来表征组织,以及蒙特卡罗技术来计算质子剂量分布。减少质子治疗不确定性的其他研究领域是正电子发射断层扫描和即时伽马成像(PGI),用于精确确定体内质子的范围。质子在穿过身体时会发生核反应,产生正电子或伽马射线的核同位素。正电子发射可能允许正电子发射断层成像,尽管理想情况下,这将在患者留在治疗台上而不是在单独的房间中进行。PGI可以在患者接受治疗和探索多种技术时提供质子剂量沉积的实时信息。迄今为止,大部分努力集中在“康普顿照相机”的开发上,该照相机使用多个伽马射线探测器来测量沉积的能量和相互作用点。康普顿照相机是大型、高度复杂和昂贵的设备,并且具有潜在的限制,例如低重合效率、高探测器负载等。PGI的一种有前途的新方法是所谓的即时伽马计时,它使用单个紧凑的检测器。它测量质子从进入身体到其射程末端时发出的伽马射线。因为质子的速度是已知的,所以从进入到检测到伽马射线的时间差产生发射点的位置。虽然PET和PGI等技术很有前景,但需要注意的是,它们仍处于发展阶段,还没有准备好用于常规临床。此外,就利润减少而言,它们将提供的好处的幅度是不确定的,仍然需要图像引导等补充技术。
与20世纪90年代开始在多个中心发展的IMRT相比,IMPT的发展正处于上升阶段,未来几年可能会进一步好转。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号