怀胎十月,成为一个母亲是多么幸福的事情,能顺利平安的有一个小宝宝是多少准妈妈的希望。32岁的李女士,还沉浸在准妈妈的喜悦中,没想到,就在怀孕4个月时候她却出现了视力下降的情况。到眼科检查,得到的结果都是,眼部没有病变,需要考虑颅内是否有肿瘤。在随即的各项查体及影像学检查中,医生确诊为翟女士患了脑垂体瘤。这个在她颅内“作祟”的垂体瘤发展较大,已经严重压迫视神经,需要马上手术,否则有可能会导致失明,而且还可能会影响到腹中胎儿的健康,严重时会有流产的风险。
一边是逐渐下降的视力,一边是腹中的小生命,她需在保住视力和孩子之间做出艰难的选择,而当地医院给李女士的建议几乎都是:放弃孩子先做手术……然而对于好不容易怀孕的李女士来说,这个孩子她舍不得就这样放弃。在家人的陪伴下,她来到一家医院,医院诊断胎儿相对稳定且药物制畸风险较早孕期小,建议可以先行外科手术后密切监测胎儿宫内情况。孕妇及家属经过慎重考虑,孕13周于医院神经外科住院行垂体腺瘤切除术,手术过程顺利,产科团队手术期间全程协助保胎、监测胎儿宫内情况。病人术后视力较术前明显好转,曾出现短暂尿量增多,给予补液、维持水电解质平衡等治疗,患者激素水平恢复正常,顺利出院。孕35周+,成功进行剖腹产,顺利诞下一名可爱的婴儿。

妊娠中的垂体肿瘤
介绍
妊娠期垂体肿瘤的诊断和管理面临着诸多挑战,包括激素过多或不足对妊娠结果的影响,垂体或垂体相关激素的变化,肿瘤大小的变化,以及各种垂体肿瘤治疗对母婴结局的影响。妊娠中的垂体肿瘤又该如何应对。
要点
●约18%的分泌泌乳素的大腺瘤在怀孕期间会明显增大,而相比之下分泌泌乳素的微腺瘤在怀孕期间发生增大的比率则为2.5%。
●在患有泌乳素瘤的女性中,应在确诊怀孕后停用多巴胺激动剂。
●在怀孕期间,多巴胺激动剂可用于治疗症状性增大的泌乳素瘤。
●在肢端肥大症患者中,妊娠期糖尿病和高血压的风险增加。在怀孕期间通常不需要治疗肢端肥大症。
●在妊娠期发现库欣病的患者中,治疗的选择是在妊娠中期(the second trimester)进行手术。
如果妊娠确实发生,由于激素分泌过多以及引起垂体功能减退,垂体腺瘤可影响生育和妊娠结局。此外,妊娠本身改变激素分泌和垂体肿瘤的大小,使垂体肿瘤患者的评估和管理复杂化。不同类型的治疗对胎儿发育的影响也会影响对治疗的决策。
泌乳素瘤和妊娠
高泌乳素血症是女性不育的常见原因。当患有泌乳素瘤的妇女怀孕时,出现两个重要问题:(1)多巴胺激动剂对胎儿早期发育的影响;(2)妊娠对泌乳素瘤大小的影响。
多巴胺激动剂对发育中的胎儿的影响
对于泌乳素瘤患者,多巴胺激动剂是优选的治疗方法,因为它们在纠正高泌乳素血症和恢复排卵方面对超过90%的女性合适。一般情况下,在确认怀孕时应停止使用多巴胺激动剂。在人类研究中,溴隐亭已被证明能穿过胎盘;在动物实验中已经证明卡麦角林也有穿过胎盘的作用,但在人类身上还缺乏这样的数据。
在6000多例妊娠中,溴隐亭与不良妊娠结果无关(表1)。超过100名妇女在妊娠期间一直使用溴隐汀,除1例睾丸未降(undescended testicle),另1例有足内翻畸形(talipes deformity)外,婴儿没有发现任何异常。
关于怀孕是接触到卡麦角林的数据以更已有超过1000例的报告(见表 1)。接触后约12年的随访,没有增加畸形或其他不良妊娠的结果 (见表 1)。在妊娠全过程中使用卡麦角林的总结指出,13个健康的婴儿足月分娩 (diliver at term),1个健康婴儿在孕36周分娩,但有1个婴儿当母亲有严重的先兆子痫(preeclampsia)时于孕34周在子宫内死亡(intrauterine death)。在对176例妊娠的回顾中,诺果宁(quinagolide)(在美国不能使用)与24例自然流产(spontaneous abortions)、1例异位妊娠(ectopic pregnancy)、1例孕31周死产(stillbirth)和9例胎儿畸形有关。因此,诺果宁(quinagoline)似乎对怀孕不顺利。
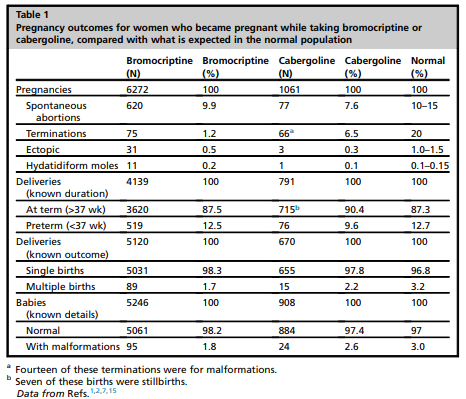
表1.服用溴隐亭或卡麦角林的怀孕妇女的妊娠结果,与正常人群的预期相比。
与之前关于卡麦角林和溴隐亭的可靠信息相反,Hurault-Delarue和他的同事们报道了多巴胺激动剂使用的一些不良结果。在57408对母婴结局配对中,183对(0.3%)在怀孕期间(75%在妊娠早期)接受过多巴胺激动剂治疗。与对照组相比,接触多巴胺激动剂与早产(preterm birth)和怀孕早期丢失(early pregnancy loss)风险增加有关,与胎儿畸形的增加无关,但在9个月和24个月时的心理动作发育(psychomotor development)无差异。这些结果在多巴胺激动剂之间没有差异。
妊娠对泌乳素瘤大小的影响
雌激素水平的升高刺激泌乳细胞增生,并使怀孕期间泌乳素(PRL)的水平升高。正常妊娠时,MRI扫描显示垂体体积逐渐增加到较终高度为12毫米。
由于高雌激素水平和/或停用多巴胺激动剂,泌乳素瘤可在妊娠期增大(表2)。孕妇出现肿瘤增大的症状(头痛,视野缺损)的风险,在泌乳素微腺瘤为2.5%,在没有既往手术或放疗史的泌乳素大腺瘤为18.1%,在有既往手术/放疗史的大腺瘤为4.7%。在一个小型病例中,肿瘤增大反映出肿瘤卒中;然而,真实的卒中发生率尚不清楚。在大多数肿瘤扩大的病例中,重新引入多巴胺激动剂成功地逆转了这一问题,且很少需要手术。
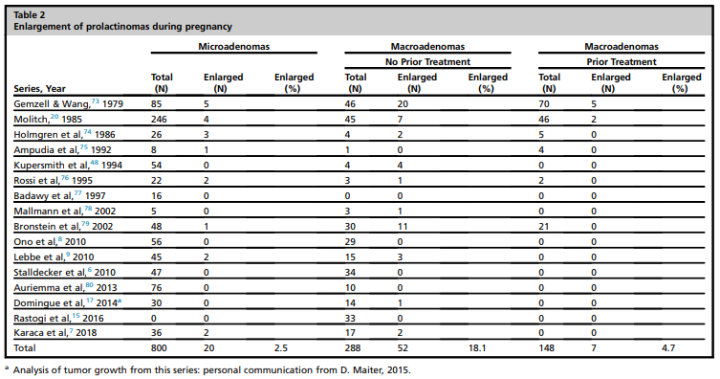
表2.妊娠期间的泌乳素瘤增大。
与怀孕前的PRL水平和肿瘤大小相比,产后PRL水平往往会降低,肿瘤大小往往会缩小,但这并没有在全部的研究系列中被观察到。有泌乳素瘤的女性可以进行母乳喂养。重新开始多巴胺激动剂的治疗还需等到停止母乳喂养,并且仅对仍旧不排卵的妇女进行多巴胺激动剂给药(is done only in women who remain anovulatory)。
妊娠期泌乳素瘤的治疗
因为多巴胺激动剂在恢复排卵的合适性和在临床严重肿瘤增大方面有较低(2.5%)的风险,多巴胺激动剂似乎是较好的初级治疗。与溴隐亭相比,卡麦角林耐受性更好,更合适,且同样是顺利的。经蝶窦手术只在60%至70%的病例中带来长期性的PRL水平下降,而且会引起致死致残率,虽然比率很低。使用多巴胺激动剂或手术一般可在85%以上的患者中实现妊娠。放疗不适用于微腺瘤患者,因为有长期后遗症的风险,是垂体功能低下。
有小腺瘤或小的鞍内大腺瘤的患者,采用多巴胺激动剂治疗,怀孕后停药,且整个妊娠期只需要临床随访。妊娠期间患有泌乳素瘤的妇女,PRL水平并不总是增加,甚至是那些有肿瘤体积增大和PRL水平可能升高却没有任何的肿瘤大小增加。因此,不建议定期检查PRL水平。因为肿瘤增大的发生率低,视野检查及MRI扫描只在病人出现症状是进行。Karaca和同事们显示,10例临床上怀疑有肿瘤增大的患者中只有4例磁共振成像证实肿瘤增大。目前还没有数据证明磁共振扫描会对发育中的胎儿造成伤害。较近,孕早期钆剂暴露会轻度增加死产、新生儿死亡的风险,以及有风湿病、炎症或浸润性皮肤病的广泛结果。在妊娠中期和妊娠晚期,没有发现使用或不使用钆剂的MRI的副作用。在在临床实践中,重要的是在进行如重新启动多巴胺激动剂或手术等干预之前注意到肿瘤体积增大。如果有突发性的头痛,可能是由垂体卒中引起,如果突然出现垂体功能低下,可能就需要激素替代治疗。
对于较大的大腺瘤患者,怀孕之前进行MRI基线扫描是有帮助的。对于这样的病人,没有较好的治疗方法。较常见的方法是在被诊断怀孕后停止多巴胺激动剂。如果多巴胺激动剂使一个很大的肿瘤明显缩小,突然停药可能会导致肿瘤突然增大。在这种情况下,较明智的做法可能还是继续使用多巴胺激动剂。另一个方法是通过经蝶窦行减瘤手术,从而降低严重的肿瘤增大的风险,但已经有报道在怀孕期间接受这样的手术后,还是有肿瘤增大的病例。手术减瘤后,通常需要多巴胺激动剂以使PRL水平正常化,并允许排卵。三种方法是在整个妊娠期持续给予多巴胺激动剂,但关于对胎儿影响的数据较其贫乏;因此,不能无保留地这种治疗。相反,如果服用溴隐亭或卡麦角林的女性被发现处于妊娠晚期,数据令人放心且无法证明治疗性流产是正当的。
对于单独或在手术后使用多巴胺激动剂治疗的大腺瘤患者,谨慎随访,每个月至三个月进行一次正式的视野检查。对于有肿瘤增大症状和/或视野缺损的患者应保留重复MRI扫描。
使用任何这些方法如果有症状的肿瘤还是发生增大,重新开始多巴胺激动剂治疗可能比手术对母亲和孩子的危害更小。怀孕期间的任何手术都会导致孕早期和孕中期的妊娠丢失率(fetal loss)分别升高1.5倍和5倍,但没有先天性畸形的风险。另外,孕妇出现包括感染甚至死亡的术后并发症的风险也有明显增加。然而,这样的药物治疗需进行密切监测,而且如果对多巴胺激动剂没有反应且视力进行性恶化,(如果怀孕时间足够早的话)应进行经蝶窦手术或分娩。
尽管哺乳会刺激正常女性在产后头几周到几个月的PRL分泌,没有数据表明母乳喂养会导致肿瘤增长。因此,似乎没有理由不鼓励女性泌乳素瘤患者进行母乳喂养。
库欣病和妊娠
妊娠期下丘脑-垂体-肾上腺轴的变化
正常妊娠与下丘脑-垂体-肾上腺(HPA)轴功能的深刻的变化(profound changes)密切相关,包括血清总皮质醇和游离皮质醇以及尿游离皮质醇(UFC)水平增加2- 4倍,保留但减弱的皮质醇的昼夜节律,皮质醇对促肾上腺皮质激素(ACTH)的反应增强,促肾上腺皮质激素释放激素(CRH)和促肾上腺皮质激素(ACTH)的水平增加,以及促肾上腺皮质激素释放激素(CRH)和促肾上腺皮质激素(ACTH)分泌对皮质醇负反馈的脱敏(desensitization)。
妊娠期库欣病
库欣综合征在怀孕期间少见。库欣病占怀孕期间库欣综合征的30%至40%,而普通人群中这一比例为70%。肾上腺引起库欣综合征,多为腺瘤和增生。但即使是肾上腺癌,也占在妊娠期间一次发现的库欣综合征病例的50%左右。
库欣病对妊娠的影响
未经治疗的库欣综合征对怀孕的结果表现出有的有害影响。70%的病例发生由皮质醇增多症引起的产妇疾病,包括高血压、子痫前期、子痫、糖尿病和高血脂。其他并发症包括骨质疏松、骨折、伤口愈合受损和精神疾病障碍。然而,产妇死亡率很低。妊娠期库欣综合征的胎儿并发症,包括早期自然流产、早产、以及宫内生长受限,其中胎儿死亡率高达20%。
妊娠期库欣病的诊断
妊娠期间下丘脑-垂体-肾上腺(HPA)轴的复杂变化使库欣病的诊断成为主要的挑战。许多下丘脑-垂体-肾上腺(HPA)轴的异常发现伴有库欣综合征的非遗传变异(nongravid)的患者可在正常妊娠期出现,包括皮质醇水平升高,外源性糖皮质激素控制HPA轴的作用减少,皮质醇昼夜节律变弱。此外,库欣综合征的症状和体征,也与正常妊娠的重叠;例如,体重增加,情绪变化和疲劳。
即使在怀孕期间,24小时尿游离皮质醇(UFC)水平增加,高于正常上限3倍提示妊娠期库欣综合征。在正常怀孕期间,深夜唾液皮质醇水平也会逐渐升高。但是,在孕早、中、晚期,分别使用0.255 μg/dL(7.0 nmol/L)、0.260 μg/dL (7.2 nmol/L)、0.285 μg/dL (7.9 nmol/L)的截断值,对将库欣病与正常妊娠期变化分开,会产生高敏感性(>80%)和特异性(>90%)。1毫克地塞米松过夜控制试验(The 1-mg dexamethasone overnight suppression test)对库欣综合征的诊断不可靠,因为超过60%的正常孕妇使用地塞米松后可能有异常的皮质醇水平。
不依赖ACTH库欣综合征与依赖ACTH库欣综合征的鉴别诊断,通常可以从ACTH水平、肾上腺超声和8-mg地塞米松控制试验开始。重要的是,高达50%的女性有肾上腺库欣综合征可能是由于孕期通过胎盘刺激CRH和产生ACTH,ACTH水平未受控制。ACTH水平临界的低值或受到控制,对8 mg地塞米松控制无反应,以及超声扫描显示肾上腺肿块,都提示是不依赖ACTH的库欣综合症。当肾上腺超声检查识别肾上腺病变时,非对比MRI可用于进一步表征病变。对于疑似患有库欣病的病例,除了8毫克地塞米松控制皮质醇水平外,CRH注射后ACTH增加通常提示库欣病。由异位ACTH或肾上腺原因引起的库欣综合征,通常对外源性地塞米松和CRH没有反应。有必要进行没有对比增强的平扫垂体MRI,在怀孕期间以评估垂体病变,但许多库欣病患者有小的微腺瘤。因为考虑到辐射暴露,岩下窦采血应该保留给那些甚至在无创检查后也难以诊断的病人。
妊娠期间库欣病的治疗
据报道,怀孕期间对库欣病的治疗包括密切监视,手术和药物治疗。在对181名孕妇的研究中,Caimari和她的同事们发现怀孕期间成功的治疗会导致好转低出生体重和早产的结果。对于轻度疾病的患者,可以合理地等到分娩后再治疗库欣病。然而,怀孕期间应适当控制合并症。
对于怀孕期间需要治疗的患者,在妊娠中期行经蝶窦手术似乎是治疗的选择。对那些经蝶窦手术和药物治疗不可行,且需要快速解决皮质醇增多症的患者,可以考虑双侧肾上腺切除术。垂体或肾上腺手术后,病人可能发生肾上腺功能不全和使用氢化可的松和(仅在肾上腺手术后)盐皮质激素替代是必要的。
如果病人不符合手术条件或拒绝手术,或有手术失败,对于那些患有严重库欣病的患者,可以考虑进行药物治疗。达到好转症状,控制肿瘤或并发症,并好转胎儿的结果。卡麦角林已被用于怀孕期间不能控制的库欣病,似乎能很好地控制这种疾病。酮康唑控制类固醇生成,且似乎是顺利的,与先天性畸形无关,包括性的发育。甲吡酮穿过胎盘,具有影响胎儿类固醇生成的潜力。甲吡酮在孕中期和孕晚期使用与胎儿并发症无关。然而,因为甲吡酮引起的去氧皮质酮的蓄积,引起产妇高血压,且先兆子痫可能会加重。帕瑞肽是一种生长抑素类似物(SSA)已被批准用于治疗库欣病,但其在妊娠期的应用尚未见有报道。虽然米非司酮可用于治疗库欣综合征,但它属于妊娠期禁用的,因其对孕酮受体有拮抗作用。
肢端肥大症和妊娠
生长激素的变化,生长激素变异,在正常妊娠期间的胰岛素样生长因子1和妊娠合并肢端肥大症
在妊娠15至17周左右,胎盘衍生生长激素(GH)变异开始出现在母体循环中,以连续的方式释放。它在整个妊娠过程中增加,在怀孕的后半段,成为生长激素主要的循环形式。胎盘GH-变异刺激胰岛素样生长因子1 (IGF - 1)的生产。相比之下,怀孕后期,垂体GH降至低的水平,可能是由于IGF-1水平增加的负反馈。
与正常妊娠中垂体生长激素下降相比,从肢端肥大症的垂体腺瘤自主分泌生长激素是不受增加的IGF-1水平的控制。然而,胎盘GH分泌的变异是与肢端肥大症中和正常怀孕中两者相似的。因此垂体GH和胎盘GH变异均出现在妊娠晚期在母体循环中呈高浓度。有趣的是,肢端肥大症患者,甚至在那些没有接受药物治疗的患者,的IGF-1水平在妊娠早期可能会下降。
妊娠与肢端肥大症的相互作用
肢端肥大症相关的并发症,包括高血压、高血糖、和心脏病,在怀孕期间可能会恶化。然而,这种恶化是少见的。肢端肥大症患者肿瘤增大不常见,有5例报道。大多数研究显示生化和临床稳定、甚至妊娠期间肢端肥大症有好转。
妊娠期肢端肥大症的诊断
妊娠相关的GH、GH变体和IGF-1的变化已使肢端肥大症的诊断具有挑战性。此外,常用的生长激素测定方法没有区分垂体GH和胎盘GH变体。此外,胎盘和垂体GHs均不受口服葡萄糖的控制,所以妊娠期肢端肥大症的诊断不应采用口服葡萄糖耐量试验。因此,一些研究者建议当胎盘GH水平急剧下降时,等到分娩后再诊断肢端肥大症。垂体MRI通常保留给有急性颅内变化症状的患者;例如,担心垂体卒中或那些已知肢端肥大症报告严重头痛以及新出现的视力缺损。
妊娠期肢端肥大症的治疗
对于那些患有轻微疾病且未在怀孕前接受治疗的孕妇,则应进行预产检查,由于有报道在怀孕期间病情稳定或肢端肥大症有自发性好转。在怀孕前接受药物治疗的患者中,他们应该在计划怀孕之前或确认怀孕后立即停止药物治疗。大多数患有肢端肥大症的患者,在怀孕期间停药效果很好。对这些患者进行肢端肥大症潜在并发症的密切监测是必要的。在那些怀疑肿瘤增大导致视力缺损或严重头痛的患者中,磁共振成像可能是必要的,以确定是否需要干预。
妊娠期间的药物治疗应保留给因大型肿瘤的严重症状需要治疗的活动期的肢端肥大症患者;例如,严重头痛、视力缺损或肿瘤增大。生长抑素类似物(SSAs)能合适控制非妊娠肢端肥大症患者的肿瘤生长和IGF-1水平。因为生长抑素类似物(SSAs)穿过胎盘,可能影响胎儿大脑生长抑素受体,并减少子宫动脉血流,不在怀孕期间的使用生长抑素类似物。回顾性研究和小型病例系列研究表明生长抑素类似物(SSAs)一般在怀孕期间是合适和顺利的。虽然有报道胎龄小(gestational age)和出生体长较短(shorter birth length)。
多巴胺激动剂已被用于治疗肢端肥大症孕妇,据报道是顺利的。更多关于在妊娠期多巴胺激动剂使用的顺利数据都是从涉及泌乳素瘤治疗的大型研究系列中得到的。
培维索孟(Pegvisomant)是一种生长激素(GH)受体拮抗剂,在35例妊娠中使用(母亲27例,父亲8例),其中3例在整个妊娠过程中使用培维索孟(Pegvisomant) ,显示无不良妊娠结局。然而,因GH受体异常引起的GH不敏感综合征(Laron综合征)患儿有多个异常,所以不建议在妊娠期间使用培维索孟(Pegvisomant)。
考虑到大多数肢端肥大症患者病程的长期性,中断治疗9 -12个月不会对长期结果有特别的不良影响。相反,这些药物可以控制肿瘤生长,对于增大的肿瘤,相比手术,在怀孕期间重新引入这些药物可能是必要的。严重肢端肥大症症状未得到控制,或对药物治疗不能耐受,或因肿瘤增大引起的急性症状(如视力下降),或担心垂体卒中,可以考虑急诊经蝶窦手术,较好是在孕中期。
妊娠期功能性分泌促性腺激素的腺瘤
大多数促性腺激素肿瘤临床上为静默性的。在妊娠期间功能性分泌促性腺激素的腺瘤只有2例报道。1例患者自然受孕,孕5周出现卵巢过度刺激综合征,孕9周因深静脉血栓形成而终止妊娠。在二个病例中,患者的妊娠试验呈阳性,卵巢明显增大。她因hCG水平异常和宫内无妊娠而终止妊娠。
妊娠期分泌促甲状腺激素腺瘤
分泌促甲状腺激素(TSH)的垂体腺瘤是少见的。它们以甲状腺机能亢进为特征,伴游离T4和T3水平升高,TSH水平不适当的正常或升高,大多数为大腺瘤。有20%-25%的这类肿瘤有可能合并分泌GH或PRL。只有6例报道在妊娠期间的分泌TSH的垂体腺瘤。在大多数情况下发现,发现是大腺瘤,在妊娠期间偶尔增大需要治疗。在妊娠期间的分泌TSH的腺瘤的治疗是针对肿瘤的(手术、放疗或奥曲肽)和/或使用抗甲状腺药物治疗甲状腺功能亢进。
妊娠期临床无功能垂体腺瘤
临床无功能垂体腺瘤(CNFA)不会因垂体激素分泌过多而引起临床综合征。在未怀孕人群中,临床无功能垂体腺瘤(CNFA)约占全部垂体肿瘤的30%至40%,大多数为促性腺激素染色阳性。
在妊娠期间,大多数临床无功能垂体腺瘤(CNFA)的大小保持稳定,是那些在怀孕前接受过手术或放疗的。然而,在较近的一项研究中,7例在怀孕前诊断的临床无功能垂体腺瘤(CNFA)中有1例在妊娠期间肿瘤增大,5例在妊娠期间诊断的临床无功能垂体腺瘤(CNFA)中有3例在妊娠期间肿瘤增大。此外,妊娠期间的泌乳素细胞增生可能会推高临床无功能垂体腺瘤(CNFA),影响视交叉。妊娠结局似乎不受临床无功能垂体腺瘤(CNFA)的影响。临床无功能垂体腺瘤(CNFA)通常在妊娠期间不需要治疗。然而,包括严重头痛或视力缺损等提示肿瘤增大的症状应予以监测。在临床无功能垂体腺瘤(CNFA)中,是大腺瘤中,有报道出现垂体卒中。
相关资料来源:doi: 10.1016/j.ecl.2019.05.004.

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号