恶性原发性脑肿瘤是儿童和青年癌症死亡的主要原因,治疗选择很少。在成人中,胶质母细胞瘤是较为常见的原发性脑肿瘤,尽管手术切除、靶向放疗、大剂量化疗和电场治疗(TTF)等新方法均在治疗方面展现出不错的效果,但它仍然是致命的,中位生存期为21个月。尽管早期发现了这些肿瘤的基因驱动因素,但它们包含的编码突变相对较少,而且它们的瘤内异质性突出。此外,这些肿瘤和宿主器官的独特特征阻碍了免疫治疗方法。大脑中的免疫系统与其他地方的免疫系统遵循着不同的原则,即通过血脑屏障(BBB)限制对肿瘤的接触,宿主受到内源性和治疗诱导的免疫控制。因此,原发性脑肿瘤是一种毁灭性的疾病,其独特的特征是一个相当重要的话题。
大脑中的免疫特权。CSF,脑脊液
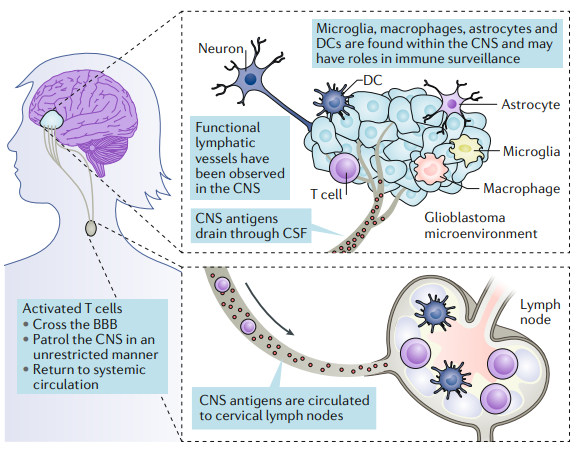
在历史上,中枢神经系统(CNS)被认为是孤立的免疫系统。促成这一认识的特征是血脑屏障(BBB)中存在紧密连接,缺乏典型的淋巴引流系统,以及经验数据显示中枢神经系统内对外来组织的排斥有限。然而,今天免疫特权的概念已经被部分重新定义。现在已经清楚,在中枢神经系统中存在着功能淋巴管,各种类型的抗原提呈细胞(APCs)存在于中枢神经系统中,包括小胶质细胞、巨噬细胞、星形胶质细胞和典型的APCs如树突状细胞(DCs)。现在我们知道,中枢神经系统不能从活化的T细胞中分离出来,T细胞可以不受限制地“巡视”这些隔间,而且中枢神经系统抗原可以在局部或颈部淋巴结引流处出现。
脑转移、内源性和操纵免疫应答的免疫检查点阻断颠覆,长期以来是胶质母细胞瘤的标志,也越来越多地在脑转移中被认识。大脑已经进化出多种旨在控制炎症反应的机制,限制了T细胞反应的通路和范围。反过来,颅内腔室的肿瘤常常能够篡夺这样的机制来限制抗肿瘤免疫反应。与胶质母细胞瘤相似,脑转移瘤的T细胞浸润量往往比其周边肿瘤的T细胞浸润量少,而成功浸润的T细胞会受到进一步控制的影响,从而促进诸如耐受性和衰竭等功能障碍。脑内浸润的肿瘤中有大量的小胶质细胞和单核细胞,它们可能较终起到控制细胞介导的免疫反应的作用,这是脑转移所使用的一种功能。虽然全身和局部免疫中枢神经系统转移的后果也不认为在原发性脑肿瘤,目前数据显示由许多相同的微环境免疫控制因素的贡献,包括调节性T细胞和值得注意的程序性细胞死亡的蛋白质的表达1配体1 (PDL1)。大量的研究已经证明T细胞的无效与免疫检查点的表达相关。未来免疫治疗的成功将取决于加深我们对脑内转移性肿瘤和免疫人群之间相互作用的理解。
恶性脑肿瘤,特别是原发性胶质瘤仍是免疫治疗的艰巨任务,因为在肿瘤、宿主和治疗这些具有挑战性的病变的标准疗法之间可能存在一系列复杂的相互作用。这些肿瘤往往很少有能被免疫治疗靶向的突变,而且几乎没有一个突变是同质地表达的。此外,这些肿瘤的基因进化导致了肿瘤群体的异质性,因此很难针对单一抗原进行治疗。不幸的是,针对肿瘤相关抗原或多种抗原的治疗有可能对大脑和全身组织产生意想不到的后果。主机也提供了不同的挑战。随着时间的推移,中枢神经免疫特权的概念已经被侵蚀,大脑处理异物的方式与宿主其他器官的方式完全不同,我们提供的访问大脑的治疗机会是有限的。此外,脑部肿瘤似乎能够促进骨髓隔离可能攻击肿瘤的免疫细胞。较后,这种疾病的标准疗法,主要是放疗和化疗,都严重控制免疫,阻碍了许多免疫治疗的尝试。
值得注意的是,目前中枢神经系统肿瘤的一线治疗方案仍是较大水平的肿瘤切除及全切,放化疗作为辅助治疗手段,而免疫疗法则只有在具有特异性、能够成功地传送到大脑并合适地处理细胞异质性的情况下才会成功。虽然距离攻克胶质瘤还需要更多的临床实践和时间,但全国际的肿瘤专家从未止步。INC国际神经外科顾问团(WANG)的专家成员加拿大James T. Rutka教授、意大利Di Rocco教授、美国Mitchel Berger教授等均在此领域颇有造诣,国内患者可拨打400-029-0925咨询INC海外教授,听取其咨询意见、获取免疫疗法的更多前沿讯息。
参考文献:Doi:10.1038 / s41568-019-0224-7

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号