“垂体瘤手术后可高枕无忧?”—— 复发风险的循证医学证据
“部分观点认为脑垂体瘤手术操作简便,术后无需担忧复发 —— 临床实际是否如此?” 相关研究证实:受限于解剖学因素,手术全切存在较高难度,此类患者中肿瘤进展或复发往往难以避免。垂体瘤术后 5-10 年的复发总风险介于 30%-50% 之间。肿瘤不完全切除具有较高复发率,具体取决于残留病灶体积:15% 的鞍内残留肿瘤在 5 年内出现进展,相比之下,51% 的鞍外残留肿瘤在 5 年内呈现生长态势。
总体而言,无论采取何种手术术式,再次手术的全切除率(GTR)均低于首次手术。术后再手术的全切除率为 46.6%-53.5%,而首次手术的全切除率可达 69%-71%—— 这凸显了首次手术决策的关键性。《Clinical Endocrinology (Oxf)》杂志刊登了英国 University Hospital of Wales 的此项研究成果。

垂体腺瘤的生物学特性与复发病理基础
垂体腺瘤(PAs)属于良性病变,经鼻蝶窦手术是治疗垂体腺瘤的主要手段。通过积极治疗,部分垂体瘤病例可实现无复发。然而,若垂体瘤病情较为复杂,与周围组织关系紧密,部分垂体腺瘤会表现出侵袭性行为,一旦手术未能达到全切除,将导致肿瘤复发。垂体功能障碍、与侵袭相关的风险因素以及其他并发症,对复发性垂体腺瘤患者的生活质量产生了显著影响。
临床典型病例:复发性垂体瘤的诊疗全程实录
病例 1:巨大垂体瘤复发后的根治性手术与长期随访
Estelle 在医学检查中被确诊为巨大无功能性垂体腺瘤。她曾于其他医院接受显微镜下经蝶窦入路肿瘤切除术。术后,针对右侧海绵窦内的小残余肿瘤进展,接受了 5040 Gy 的分割放疗。
然而,在完成放疗一年后,Estelle 出现右侧动眼神经麻痹症状,MRI 检查显示其右侧海绵窦内肿瘤复发且病灶有所进展。
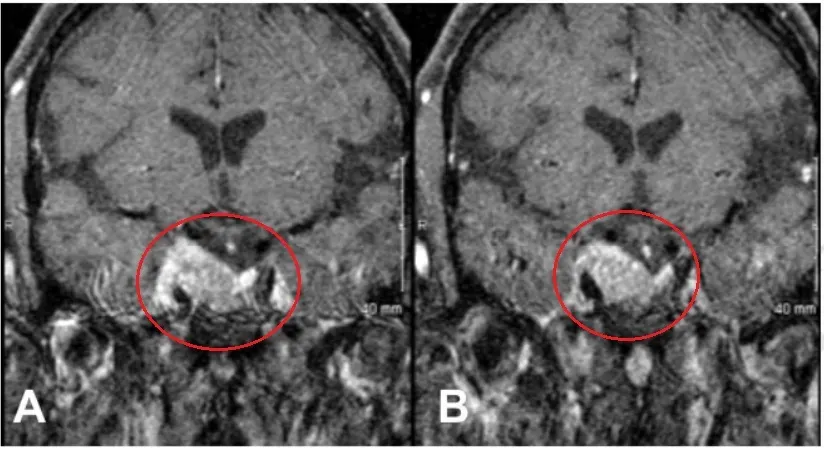
术前影像学特征:肿瘤持续生长并侵入海绵窦区域。
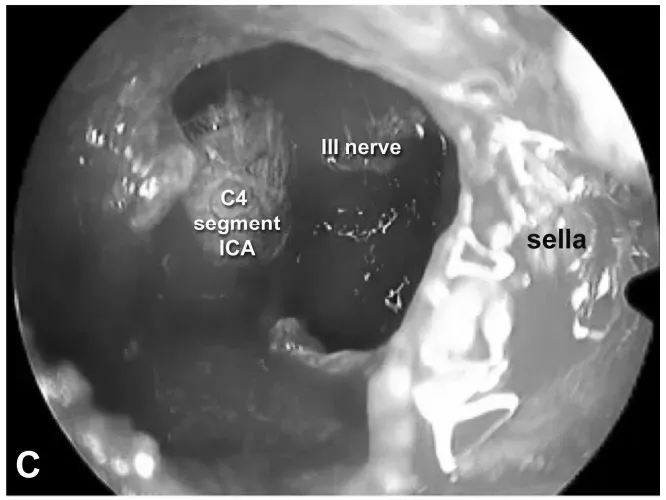
INC 福教授为 Estelle 实施标准经鼻经蝶窦入路内镜手术,随后通过移除海绵窦颈内动脉前段的骨质,对术野进行外侧扩展。
手术路径选择:内镜下经内侧三角入路。
术后,Estelle 的动眼神经麻痹症状得到缓解,术后恢复过程平稳。患者维持术前的药物治疗方案。病理学检查结果确认病变为垂体腺瘤,未发现恶变特征。
经过三年的随访观察,影像学检查未发现肿瘤复发或进一步生长。

病例 2:巨大侵袭性垂体瘤的多次复发应对策略
年仅 8 岁的 Eva 罹患巨大侵袭性垂体瘤,其视力出现急速下降,右眼视力一度降至 0.03,这意味着她在 1 米处才能看清正常视力者在 60 米处可见的物体。随之而来的是难以缓解的头痛,以及月经不调等症状……
Eva 最初选择药物治疗,每日服用卡麦角林。然而,在卡麦角林的治疗作用下,肿瘤体积未出现明显变化,药物治疗宣告失败。首次手术未能实现肿瘤完全切除,在 8 年后,垂体瘤疾病再次复发,Eva 接受了二次手术,但术后仍有肿瘤残留。四个月后,Eva 转至神经外科接受进一步治疗。第三次手术能否确保安全实施,并帮助其恢复视力?
影像学资料:
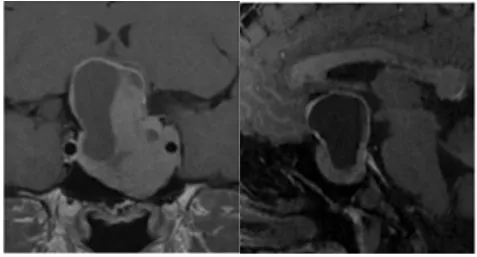
图 1:初始病灶形态
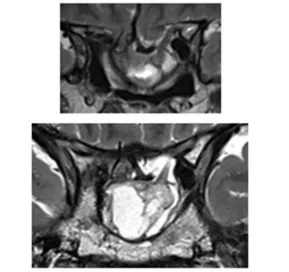
图 2:影像显示首次肿瘤切除 8 年后复发,伴随脑出血和鞍底下陷
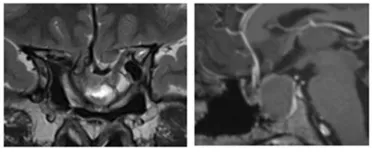
图 3:二次手术后 MRI 显示肿瘤残余,继发性空蝶鞍综合征伴随鞍区前交通动脉复合体向下移位。
在法国巴黎的 Lariboisiere 大学医院,福洛里希教授制定了个体化治疗方案:“第一步实施经鼻内镜入路视交叉‘固定’术。第二步完成肿瘤切除,并进行鞍底重建。在防止肿瘤复发的同时,缓解当前的视力下降困境。”
术后一年,MRI 检查显示肿瘤全切除、脂肪填充空蝶鞍。术后左侧视野显著改善,视力稳定在 0.3,右侧视力从 0.03 提升至 1.0,达到正常视力水平。
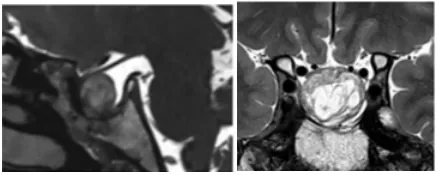
INC 国际垂体瘤手术专家观点集萃
01 术后残留是影响复发的核心因素
术后肿瘤残留是垂体腺瘤(PA)复发的主要影响因素。位于鞍外的残留腺瘤复发风险是局限于鞍内残留腺瘤的 3.7 倍。对于存在鞍外或鞍内残留的患者,术后 10 年的复发率显著高于术后 5 年(鞍内残留:58.3% 对比 15.4%;鞍外残留:76.9% 对比 51.4%)。因此,针对存在鞍外残留的患者,应采取更为积极的临床干预策略。
一项调查数据显示,接受全切除术(GTR)的患者复发率为 24%,而存在手术残留的患者中肿瘤再生长率达 47%。此外,术后 5 年、10 年和 15 年的总体复发率分别为 25%、43% 和 61%。既往研究一致认为,手术无残留与复发风险降低密切相关。实际上,术后存在腺瘤残留的患者中,32% 在术后 2.2-6.3 年内出现肿瘤复发,而无腺瘤残留的患者中,仅有 8% 在术后 5.0-6.5 年内出现复发。
完整切除术的解剖学制约因素
能否实现肿瘤完全切除取决于多种因素,包括肿瘤的质地和侵袭性。许多放射影像学特征是手术效果不佳的警示信号,如多叶状巨大腺瘤、骨质侵袭和海绵窦受累。对于功能性和无功能性腺瘤,改良 Knosp 分级是预测肿瘤切除率的有效工具,该分级系统描述了腺瘤与颈动脉的解剖关系。
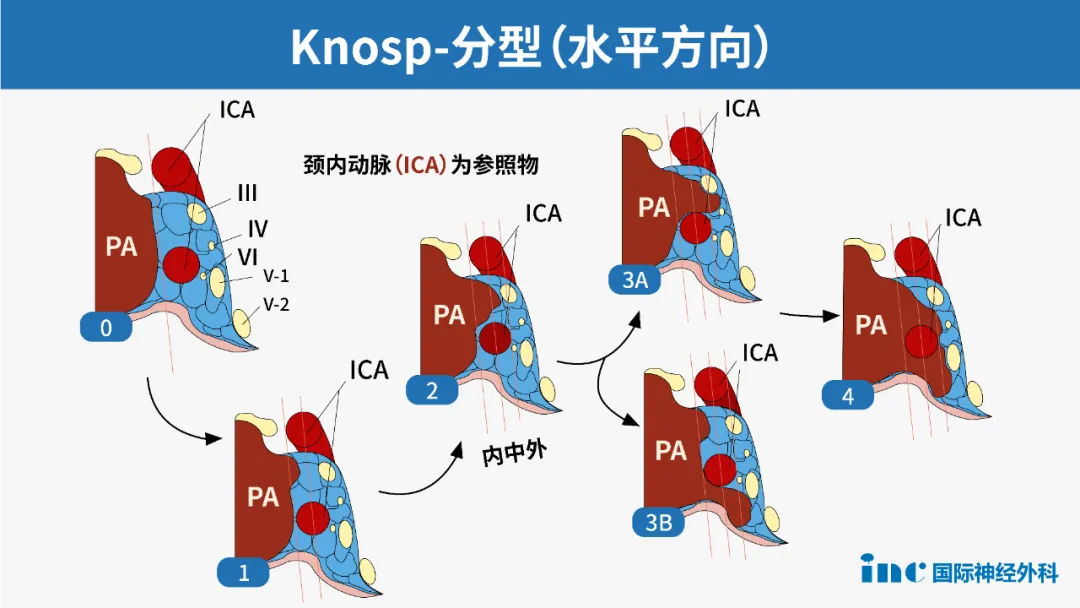
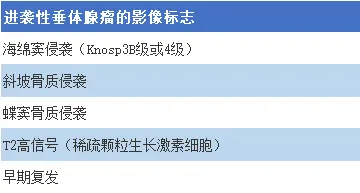
侵袭性垂体腺瘤的临床特征
已证实,多数垂体腺瘤表现出良性生物学特征,多年来复发率相对缓慢,其自然病程受手术切除的解剖学限制因素影响。然而,部分腺瘤亚型呈现快速复发且对治疗产生抵抗性。许多临床中心认为,Ki-67 指数为 7%-10% 时更具临床相关性,可预测肿瘤的进袭性行为。在当前的分类体系中,尽管 Ki-67 仍然是进袭性行为的重要标志,但尚未定义统一阈值,肿瘤侵袭(如海绵窦或斜坡侵袭)的额外证据也应被视为临床进袭性行为的标志。
免疫组织学亚型
2021 年第 5 版《世界卫生组织(WHO)中枢神经系统肿瘤分类》(CNS5)对垂体肿瘤的分类进行了修订,明确指出某些垂体腺瘤(PAs)特殊亚型表现出更强的侵袭性行为且复发风险更高。这些特殊亚型包括:
Crooke 细胞腺瘤
静默性促肾上腺皮质激素细胞腺瘤
男性泌乳激素细胞腺瘤
多激素 PIT + 腺瘤
稀疏颗粒性生长激素细胞腺瘤
肿瘤体积因素
腺瘤体积较大可能降低腺瘤全切除的概率,进而对预后和复发率产生影响。Hofstetter 等人研究了腺瘤大小对切除程度的影响,观察到体积大于 10cm³ 的垂体腺瘤(PAs)更易出现术后残留。
02 垂体瘤复发后的治疗选择
垂体瘤术后再次手术具有显著挑战性,解剖结构可能被疤痕组织破坏。原手术路径和术区形成瘢痕,重要神经血管与肿瘤发生粘连,肿瘤组织和垂体的界面有时难以清晰分辨,导致再次手术的难度显著高于初次手术,尤其是经蝶窦入路手术,再次手术会使颈内动脉损伤的风险明显增加。
相关研究表明,术后再手术后视力下降的风险更高,先前的放射治疗可导致局部组织去血管化,限制了颅底重建的选择,从而增加术后脑脊液漏的风险。此外,肿瘤残留通常位于解剖位置不利的区域,但在经验丰富的垂体瘤诊疗中心,在考虑其他治疗方案之前,可采用扩大内镜入路切除此类腺瘤。这凸显了配备专业垂体瘤外科医生的三级垂体瘤诊疗中心的重要性。
总体而言,无论采用何种手术方式,复发后再次手术的全切除率(GTR)均低于首次手术。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号