2021年11月1日,日本一三共宣布其溶瘤病毒疗法Delytact正式在日本上市,用于治疗恶性胶质瘤患者,定价143万日元(折合人民币8万元)一针。这是一款获批用于原发性脑胶质瘤治疗的溶瘤病毒产品。据了解,Delytact是一款基于单纯疱疹病毒(HSV-1)开发的三代溶瘤病毒,同时也是国际上首款通过基因改造HSV-1来治疗癌症的疱疹病毒药物。
恶性胶质瘤1年生存率高达92.3%
胶质瘤是常见的原发性脑肿瘤,约占全部脑肿瘤的80%。恶性脑胶质瘤具有进展快、复发率高、预后差等特点,中位生存期不足20个月,5年生存率仅为5%,迫切需要更合适的治疗手段。
溶瘤病毒疗法Delytact(teserpaturev/G47)的出现为脑胶质瘤的治疗带来了新的转机。根据相关临床数据统计,溶瘤病毒疗法Delytact治疗恶性脑胶质瘤的1年生存率高达92.3%,是常规治疗的6倍左右,提升了恶性脑胶质瘤患者的生存率。
“以毒攻毒”的溶瘤病毒是怎么做到的?
溶瘤病毒(oncolytic virus,OV)是一类天然或经过基因改造的病毒,能够特异性地感染并杀伤肿瘤细胞,同时对正常细胞不会造成过多有害影响。换句话说就是以毒攻毒,用原本“有毒”的病毒,去干掉“有毒”的肿瘤。
较初,国际医学杂志The Lancet报道了流感病毒会使患者体内的肿瘤消退,由此产生了溶瘤病毒这一新兴概念,而后国际各地的研究人员就此展开了一系列的研究,如今已经有160多种不同的溶瘤病毒正在进行临床前研究及临床试验。

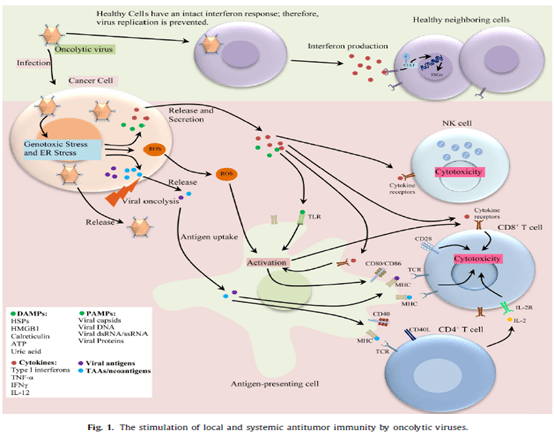
溶瘤病毒可以诱导机体的抗肿瘤免疫反应逐渐被人了解到。肿瘤免疫控制的微环境,造成免疫系统无法识别肿瘤并进行攻击。溶瘤病毒也是病毒,特点就是感染、复制并裂解细胞,通过释放免疫抗原激活免疫控制。
溶瘤病毒介导的抗肿瘤杀伤机制
1、病毒直接感染肿瘤杀伤:肿瘤细胞自带高代谢和高增殖的特点,有利于病毒利用肿瘤细胞的能量实现自身增殖,一方面导致肿瘤被病毒不断繁殖撑死,另一方扩散出病毒能够裂解细胞,产生具有细胞毒性和溶瘤活性的物质,并由此得名。
2、病毒损害肿瘤血管系统杀伤。部分通过静脉给药的病毒可以直接感染并损害肿瘤血管,而对正常血管没有影响,损害肿瘤血管系统控制肿瘤的生长。
溶瘤病毒激活免疫系统起到抗肿瘤机制
1、病毒刺激已存在肿瘤组织中的免疫细胞,感染后能够释放例如Cytokines等不同因子,调动招募递送免疫细胞进行杀伤。
2、许多肿瘤细胞在抗病毒信号传导方面存在缺陷,因此支持选择性病毒复制,针对肿瘤细胞进行感染避免了对正常组织的杀伤。
3、被溶瘤病毒裂解的肿瘤细胞释放大量肿瘤蛋白,可以被特异性免疫识别(增加肿瘤抗原暴露、调节肿瘤微环境、增加肿瘤微环境免疫细胞浸润、活化免疫细胞、刺激机体免疫系统等来诱导全身系统的抗肿瘤免疫反应来杀伤肿瘤),从而达到“肿瘤疫苗”相似的效果。
溶瘤病毒种类及进展
病毒株的选择是溶瘤病毒开发关键要素之一,目前已有10余种病毒用于开发OVs,据统计,应用较广的4种病毒分别为腺病毒(31%),疱疹病毒(24%),呼肠孤病(20%)和牛痘病毒(12.5%),其他在研究的还包括新城,柯萨奇,麻疹病毒等。
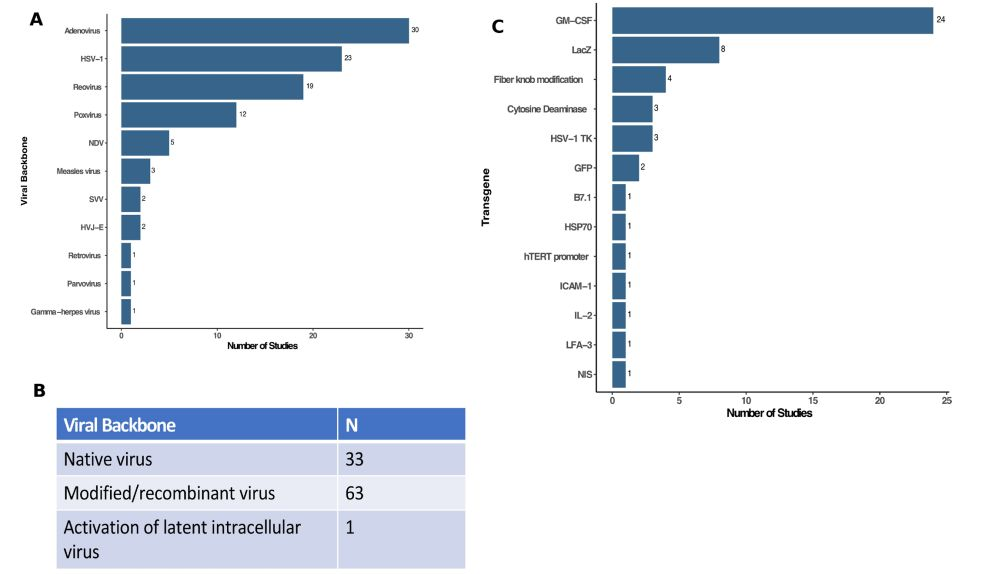
腺病毒:较常见人类病原体,可引起上呼吸感染症状,HAdV-C5应用较广。通过缺失病毒基因组E1A和E1B,可构建特异性感染Rb/p53突变型肿瘤的溶瘤病毒。安柯瑞即通过缺失WT-Ad5的E1B-55KD和E3结构实现更特异地裂解肿瘤细胞。
单纯疱疹病毒:具2种血清型,为嗜神经性双链DNA,基因组大,适合较大基因片段插入。HSV-1流行较广,成年人血清阳性率85%以上。T-VEC为缺失ICP34.5(编码神经毒性因子)和ICP47(控制宿主抗病毒固有免疫途径蛋白激酶,PKR-IFN),同时引入GM-CSF增强抗肿瘤免疫应答。呼肠孤病毒:双链RNA病毒,具有3种血清型,产生呼吸道/肠道自限性感染,可在Ras通路过度活跃的细胞中复制,可携带外源基因小,操作难度相对大。牛痘病毒:双链DNA病毒,可携带大的外源基因片段,倾向于感染代谢旺盛的细胞。目前主要通过缺失TK(病毒胸苷激酶),B18R(I-IFN结合蛋白),VGF(病毒生长因子)等增强肿瘤选择性。表1.常见病毒类型及特点。

恶性胶质瘤的溶瘤病毒疗法
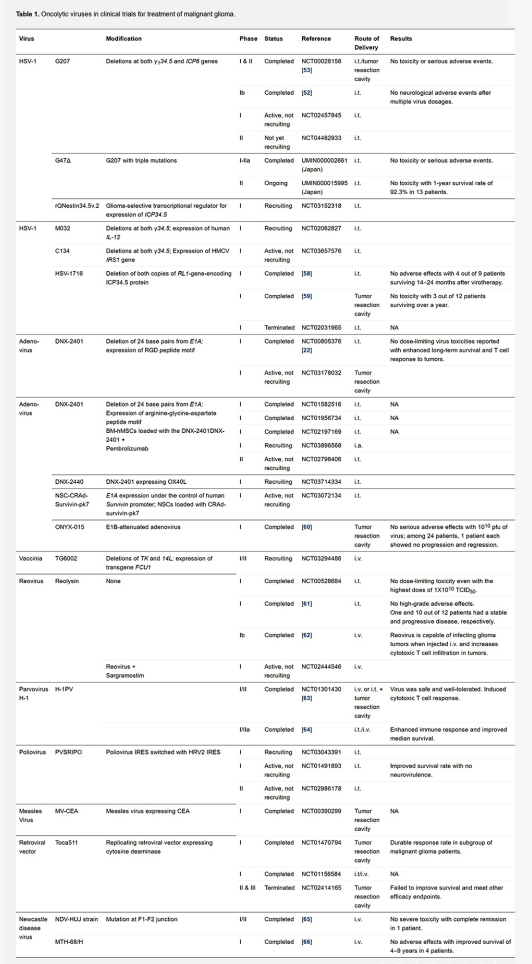
由于存在一些障碍,包括血管和血脑屏障、肿瘤保护性免疫环境以及肿瘤细胞分子属性的高度可变性,溶瘤病毒疗法面临着与恶性胶质瘤相关的一系列独特挑战。大多数在恶性胶质瘤患者临床试验中的溶瘤病毒(如果不是全部)都在局部递送,以在肿瘤中实现合适的病毒载量。
目前,疱疹病毒、腺病毒、痘苗病毒、呼肠孤病毒、细小病毒、脊髓灰质炎病毒、麻疹病毒、复制型逆转录病毒载体和新城疫病毒(NDV)正在恶性胶质瘤患者中进行不同临床阶段的顺利性和合适性测试。
尽管在神经胶质瘤患者中进行测试的大多数溶瘤病毒候选药物都经过基因改造以提高其顺利性,但仍有少数被设计用于表达治疗性免疫刺激蛋白。被设计为表达免疫刺激蛋白的溶瘤病毒不仅可以损害免疫控制性TME,还可以在肿瘤部位募集、激活和促进促炎免疫细胞。设计溶瘤病毒以在肿瘤部位提供治疗性蛋白质的合适载荷已成为一种公认的优化治疗效果的策略,同时较大限度地减少这些治疗性蛋白质提供的全身毒性。
仍然存在的挑战
1、突破血脑屏障:
在全身给药后,溶瘤病毒在到达肿瘤之前需面临几个障碍,包括补体因子或抗体的中和以及抗病毒免疫细胞反应。此外,肝、脾、肺和组织驻留巨噬细胞等组织中的非特异性病毒摄取进一步降低了可以到达肿瘤的病毒载量。此外,由于物理屏障,病毒从血管到血管外隔室的低效外渗减少了病毒颗粒到达肿瘤。病毒从血管到血管外隔室的CNS调节通道中的物理BBB甚至更加严格。中枢神经系统的微血管结构是不同的,不同的细胞类型,如内皮细胞、周细胞、小胶质细胞和星形胶质细胞,形成了一个复杂的交互系统。BBB中连续的非开窗血管严格调节分子、离子和细胞穿过血管膜到大脑的运输,这对于维持神经元的稳态和较佳功能至关重要。此外,BBB在保护大脑免受炎症、毒素和损伤方面发挥着关键作用(如[34]中所述)。然而,血脑屏障是向位于CNS区室的肿瘤(包括OV)提供全身治疗的主要障碍

恶性胶质瘤溶瘤病毒治疗的障碍概述。(A)病毒的中和和非特异性过滤。全身给药的溶瘤病毒容易被补体和抗体介导的吞噬巨噬细胞中和和摄取。病毒颗粒在肺、肝脏、脾脏和其他组织中经过进一步非特异性过滤,从而减少到达肿瘤的病毒颗粒总数。(乙)血脑屏障。跨血管进入脑组织的运输受到专门的血管周围细胞结构(称为血脑屏障)的严格调节,这也阻碍了溶瘤病毒向中枢神经系统隔室内的肿瘤的运输,从而减少了进入肿瘤的病毒载量.(C)免疫控制性肿瘤微环境。由于肿瘤细胞表达高水平的肿瘤坏死因子(TGF)-β和吲哚胺2,3-双加氧酶(IDO),免疫控制细胞如M2表型小胶质细胞/巨噬细胞、髓源性控制细胞、调节性T细胞被上调和维持,在肿瘤周围形成肿瘤保护环境
2、改变肿瘤格局:从冷到热
恶性脑肿瘤仍然是不治之症。尽管在好转患者预后方面付出了很多努力,但肿瘤异质性高、肿瘤诱导的免疫控制微环境强、突变负荷低等多重因素使得这些肿瘤的治疗特别具有挑战性。因此,迫切需要新的治疗策略。溶瘤病毒(OV)是一种生物治疗剂,已被选择或设计用于感染和选择性杀死癌细胞。越来越多的临床前和临床研究证明溶瘤病毒能够聚集T细胞并诱导针对病毒和肿瘤的持久免疫反应,将“冷”的肿瘤微环境转变为“热”的环境。除了作为单一疗法的有希望的临床结果外,OVs可以与其他癌症疗法强有力地结合,通过在抗击脑癌中产生协同效应来帮助克服关键障碍。尽管要充分发挥溶瘤病毒的治疗潜力,仍有许多问题需要回答,但溶瘤病毒疗法显然将成为未来恶性脑肿瘤患者治疗的一部分,相信越来越多的脑瘤患者将因此获益。
参考文献:
1.DOI:10.1136/jitc-2020-001486
2.DOI:10.3390/v13071294

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号