丘脑肿瘤如何顺利手术?丘脑的深部位置及其邻近重要的神经和血管结构对愿意进行丘脑手术的外科医生来说是一个较大的挑战。虽然丘脑肿瘤的保守态度占据了文献的主导地位,但是手术后辅以辅助治疗仍然是丘脑肿瘤的优选方法,且需要选择具有丰富成功经验和高超技术的神经外科医生团队。
AIT=前半球间经胼胝体;CC=胼胝体;EOR=切除范围;GTR=完全切除;IC=内囊;IOS=术中超声;KPS=Karnofsky性能状态;m3VC=显微外科3VC;NTR=近全切;PeCSS=对侧小脑上松果体上中央区;PeST=中央区小脑上经幕;PITS=后半球间经小脑幕下;STR=次全切除术;TCi=经小脑;TCTV=经胼胝体经脑室;VPS=脑室-腹腔分流术;3T ioMR=术中3-T MRI;3VC=三脑室脑池造口(引流)术
到达丘脑是一项艰巨的任务,因为几乎50%的丘脑表面在侧面被内囊(IC)所覆盖,而下丘脑和中脑的前部则被覆盖。因此,通过外侧皮质通路的手术入路损伤了雄辩的正常脑实质。尽管有这些数据,文献表明,跨皮质的方法被广泛采用损伤。但是丘脑表面相当大的一部分与池或脑室腔相邻,因此可以通过经小脑入路(TCi)或经胼胝体经脑室(TCTV)入路到达对正常脑实质的损害。清晰可识别的解剖标志物允许将这个表面分割成四个手术可触及的丘脑表面:侧脑室、帆膜、池和三脑室(图1)。丘脑内的大多数病变可以通过这些表面之一顺利到达。而这些表面中的每一个又可以通过以下一个或多个TCTV或TCi入路(图2):前半球间经胼胝体(AIT)、后半球间经小脑幕下(PITS)、中央区周围小脑上经小脑幕(pess)和中央区对侧小脑上松果体上(PeCSS)。侧脑室和帆膜表面较好通过AIT入路,池面较好通过PeST或PITS入路,三脑室面较好通过PeCSS入路。
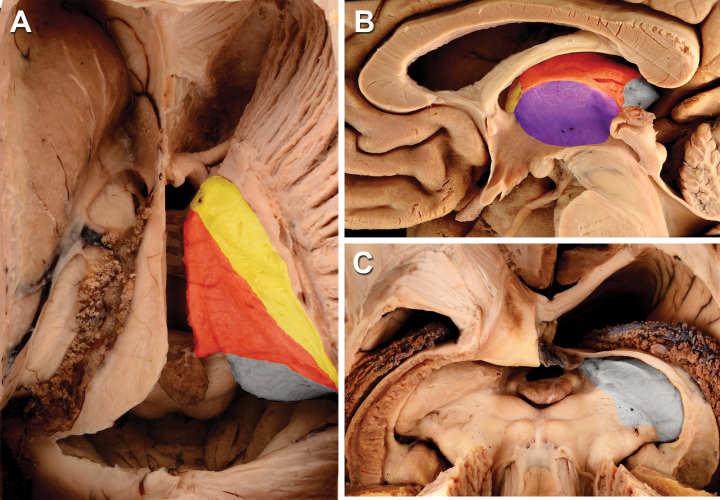
图1:丘脑游离面轮廓。红色表示帆膜表面;紫色表示三脑室表面;灰色表示池表面;黄色表示侧脑室表面。图片来源:World Neurosurgery, 97, Serra C, Türe U, Krayenbühl N, Şengül G, Yaşargil DCH, Yaşargil MG, ographic classification of the thalamus surfaces related to microneurosurgery: a white matter fiber microdissection study, 438–452, Copyright 2017, with permission from Elsevier.
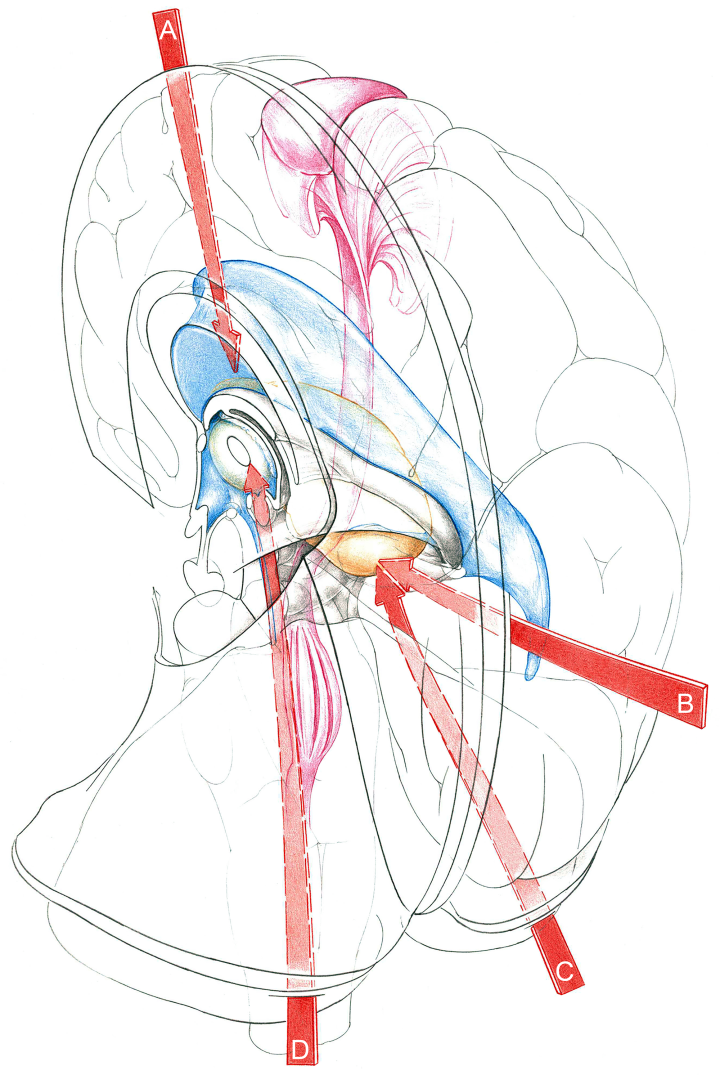
图2:说明可用的TCi和TCTV方法。右半球丘脑在上后内侧斜视图上呈橙色。左半球被切除了。侧脑室和三脑室呈蓝色。锥体束呈粉红色,从中央前回穿过IC(因此位于丘脑外侧)和大脑脚,向周围延伸。经小脑前外侧入路;经小脑前外侧入路(经小脑前外侧入路)。这些途径要么沿着大脑半球间裂,要么沿着横裂;也就是说,分别沿着镰或天幕走,这也如图所示。图片来源Uíur Türe。
丘脑手术预后的影响因素
在文献中,丘脑手术的结果是可变的:GTR率从0%到81%不等,长期性发病率在0%到84%之间。EOR报告不一致。有几个因素可以导致这种变异性:外科医生的经验,不同的发病率和GTR/EOR评估标准,病人和组织病理学的异质性,以及不同的手术方法。
TCi理念的实施对手术结果至关重要。在较近的一项研究中,我们阐明了丘脑的地形解剖学,提出了将丘脑的自由表面分割成侧脑室、帆膜、池和三脑室表面。术中每个表面都有清晰可见的解剖标志物,这对于术中定位至关重要,如果通过TCTV或TCi途径接近表面,则很容易识别。这样,就不需要对健康的脑实质进行不必要的操作。
一旦顺利到达较合适的丘脑表面,丘脑病变倾向于局限于丘脑,这一事实有助于目标病灶的清除。据Yaşargil报道,丘脑病变呈扩张性生长,甚至可能导致周围结构如IC或下丘脑的大位移,而没有的浸润。因此,划定手术可及丘脑表面的标志通常被保留下来,可作为可靠的解剖标志,指导顺利切除。此外,由于周围的解剖结构被移位而不被浸润,所以可以保留下来。这对与IC密切接触的病变患者很重要。
据报道,IC是较常见的发病源。根据我们的经验,如果避免经皮质入路,如果进行单纯的皮损切除术,如果IC的血管供应得以保留,IC受损的风险可以保持在较低限度。进行单纯性病灶切除术需要正确区分肿瘤组织和健康组织。这并不容易,是在低级别胶质瘤的病例中,其质地和一致性通常与正常丘脑相似。然而,高级别的肿瘤组织通常比健康组织结构松散,因此可以更容易地用低功率抽吸去除。此外,它通常更容易扩散渗出。手术辅助物如ioUS和3T ioMR,以及术中神经监测也有帮助。尽管如此,肿瘤的边界很难识别,而且很可能会残留一层薄薄的肿瘤,占26%的NTR和8%的STR。3T-ioMR有助于获得GTR;然而,鉴别残留肿瘤和水肿或手术挫伤并不总是直接的。由于丘脑和IC的血管化来源不同,IC的损伤是可以避免的。丘脑由后循环(主要是后交通动脉的分支)供血,IC主要来自前循环(脉络膜前动脉和豆状纹状体外侧动脉),这两个区域之间的血管边界意味着在所述丘脑表面解剖范围内的动脉止血可以顺利地进行,而不会损坏IC。然而,这并不适用于静脉系统(是丘脑纹状静脉),因为其分布模式无法评估。
丘脑肿瘤手术入路的选择
预先活检(立体定向)只适用于临床上高度怀疑淋巴瘤或病人的身体状况禁止手术。在全部其他情况下,手术的目的是尽可能地提高EOR。考虑到丘脑病变的少见性和每一位新患者所面临的不同挑战,在选择手术入路时没有教条的算法。需要灵活的态度和准备从一种方法平稳过渡到另一种方法。
如果肿瘤到达侧脑室表面,并且患者表现为脑室系统扩张,AIT入路是我们的优选。这种偏好背后有三个原因。首先,首先,如果脑室扩张,脑室内的解剖结构很容易识别,因此如果来自这种途径,手术的方向和可操作性会得到好转。丘脑脑室表面的解剖界限,是丘脑纹状体静脉和终纹,因为它们标志着IC的内侧界限(即切除的外侧界限),因此指导了切除。二,通过AIT transforaminal approach,m3VC通常可以在同一程序中完成。三,AIT允许ioUS和3T ioMR。对于病变未到达侧脑室表面的患者(如术前冠状位MRI序列所示),脑室较小,或所需的攻角太陡,不优选AIT入路,应考虑后路。
PITS是肿瘤向上或向下延伸的肿瘤的一种选择,这样脾脏(脾脏是胼胝体的一部分)就不会阻碍肿瘤的轨迹。如果不是这样,那么应该选择另一种方法,因为盲目牵引突出脾脏下方但大部分隐藏在脾脏下的病变是危险的,并且对大脑内静脉构成危险。我们不后路胼胝体切开术,原因有几个:一,它在解剖学上没有用处,因为它只能进入中间膜;二,很高的神经心理缺陷可能随之而来;三,它危及大脑内部静脉和两个穹窿。PITS方法有一些优点:它允许m3VC通过终板和3T ioMR。较后,它提供了一个公平的观点,在病人谁的损害向下推动它,特别是如果一个角度的光学使用。
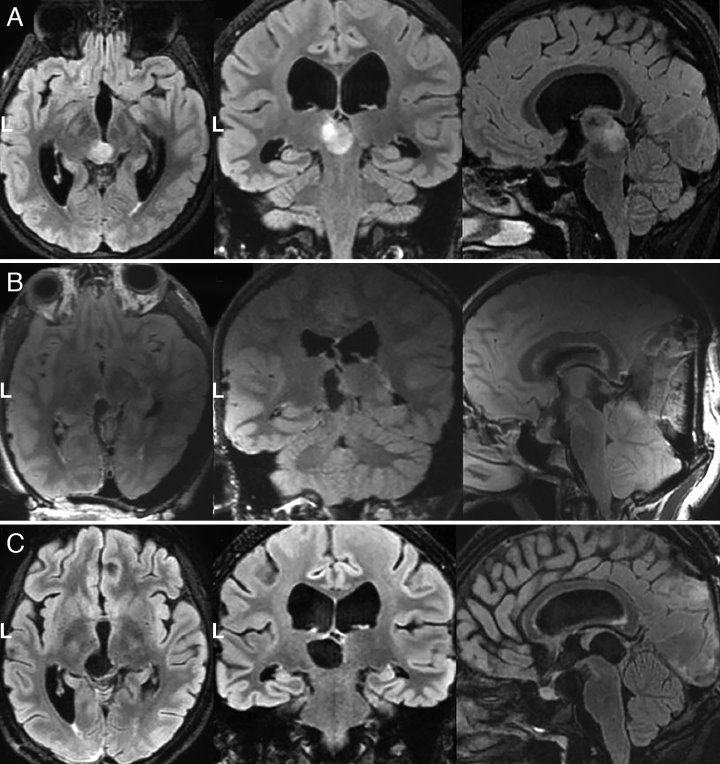
图示:图片摄于一名13岁女孩,出现严重头痛。CT显示三脑室积水,这促使急诊内镜下3VC。核磁共振显示左侧枕叶有一个病变,导致隐性脑积水。病变的影像学表现为后入路。考虑到脾和肿瘤之间的关系,无论是PeST还是PITS方法都是可能的。然而,采用PITS可以更好地观察到病灶。病人被放置在俯卧位,允许3T的ioMR。暂时性麻痹切除术仅需2个月就可完全消除。病理组织学分析显示为WHOⅡ级IDH野生型胶质瘤,患者接受了辅助治疗。A: 术前轴位、冠状位和矢状面FLAIR MRI。B: 术中FLAIR MRI。C: 术后MRI检查。
如果病变隐藏在脾脏下,PeST入路是到达丘脑池表面的可行选择。考虑到需要非创伤性重力介导的小脑放松来打开横裂,患者处于半坐姿的情况下进行PeST入路,这在我们的设置中并不意味着有相关的副作用。这种方法也提供了一个相对较长的范围,这是有利的,如果病变有一个明显的前上延伸,同时它允许我们到达肿瘤延伸到中基底颞区。PeST方法的缺点是它不允许我们执行3T-IoR。
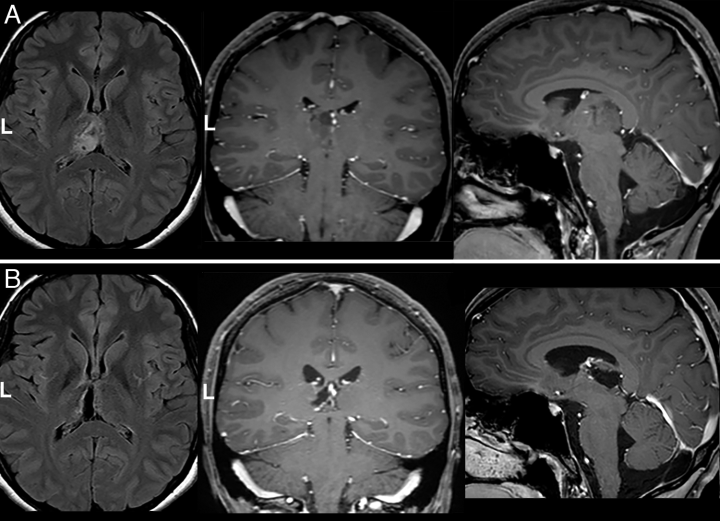
图示:一位20岁女性患者在过去2个月内一直头痛。她较终接受了核磁共振检查,结果显示左侧的枕叶有病变。病变与脾脏之间的解剖关系促使病人以半坐姿进行PeST手术。手术顺利,术后磁共振成像(MRI)显示可以达到GTR。在组织学检查中,病变被证明是少星形胶质细胞瘤(WHO II级,未另行说明)。因此,没有给予辅助治疗。A: 术前轴位FLAIR、冠状面和矢状面钆增强T1加权MRI。B: 术后影像显示结果。
对于局限于三脑室表面的肿瘤,PeCSS入路是较好的。它提供了一条通往三脑室的通路,而不需要穹窿操作或损伤正常丘脑组织。然而,全部接受PeCSS入路的患者术后出现短暂的向上凝视麻痹(通常在2个月内消除),可能是由于后连合的操作。如果病变达到脉络膜薄带或扩大脉络膜裂,则可以考虑AIT。
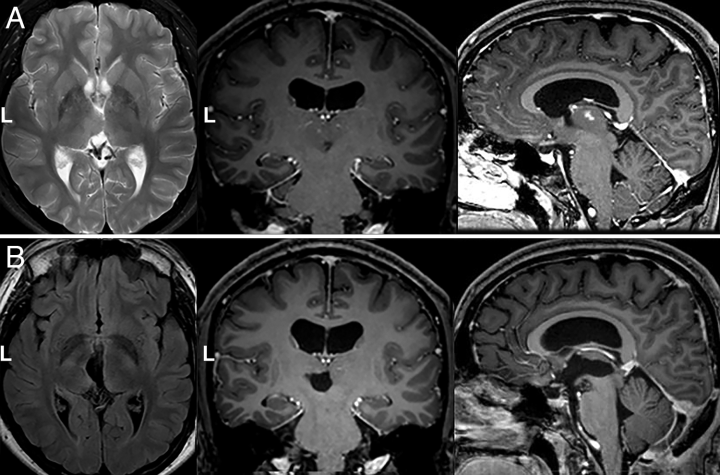
图示:图像摄于一名16岁男性,他已经经历了4年的头痛。他的核磁共振成像显示一个来自丘脑三脑室表面的病变。他的神经系统检查没有缺陷,KPS为100。他在另一家机构接受了内镜下3VC活检,然后咨询给我们进行进一步治疗。适当的神经影像学检查显示病灶与侧脑室及脑池表面之间有健康的丘脑组织,这促使患者选择半坐位的PeCSS入路。术后MRI证实GTR。术后,病人有一个短暂的向上凝视麻痹,在2个月内消失。组织病理学检查显示弥漫性星形细胞瘤为WHOⅡ级。未给予辅助治疗。A: 术前轴位、冠状位和矢状位MRI。B: 术后影像学检查。
脑脊液紊乱应对
脑脊液循环障碍在丘脑胶质瘤患者中很常见,无论是在发病时还是在发病期间。导水管在脑积水的发病机制中起着关键作用,导水管可以被病变压迫(直接或间接),也可以被手术碎片阻塞。为了较大限度地降低风险,我们不希望在手术结束时将止血剂留在原位。出于同样的原因,以及为了止血,病变切除后至少30分钟持续冲洗心室系统。
与其他恶性胶质瘤患者相比,我们也观察到更软的胶质瘤周围组织。脑组织顺应性似乎也发生了改变,如术后侧脑室塌陷,导致颞角分离。可以认为组织的一致性和顺应性不同可能导致术后导水管周围实质塌陷,较终导致脑脊液导管闭塞或闭塞,从而可能证明高级别胶质瘤患者术后脑积水发生率较高。
或者,正如文献所示,切除高级别胶质瘤可能会改变脑脊液蛋白质含量并导致交通性脑积水的发展。鉴于经验,并基于上述考虑,在技术上可行的情况下,会在常规的基础上进行m3VC手术。
手术技术支持
在术前和术中应用多种技术工具。ioUS可用于术中指导和胼胝体切开术的选择。然而,它不能用于半坐位的患者,对切除控制的帮助不如3T ioMR。3T-ioMR允许良好的术中切除控制,并允许外科医生在切除过程中承担较少的风险。但是,如果需要半坐姿,则不能使用。内窥镜在手术开始时,即在攻击病灶之前,帮助研究手术解剖,在手术结束时检查手术区域,检查盲区周围是否有EOR和止血,确保导水管通畅。术中导航和术中荧光都没有帮助。术中神经监测是常规使用,但在我们的手上,它从来没有证明是至关重要的切除。
根据我们的经验,这些技术进步有助于好转手术结果,前提是神经外科的支柱始终受到尊重。准确的解剖学知识有助于准确的地形诊断。这反过来又是决定适当的手术适应症的基础,是仔细权衡选择手术入路的基础。这三个理论支柱是精确的显微外科技术成功完成手术的先决条件。
总结
内窥镜辅助显微外科手术可以顺利地切除丘脑病变,并具有可接受的发病风险。根据我们的经验,几乎全部丘脑病变都可以通过TCi或TCTV途径从四个游离丘脑表面(侧脑室、腹主动脉、脑池和三脑室表面)之一进入。这些方法有助于优化术中定位和接近四个丘脑表面中的一个或多个,而无需对正常脑实质进行不必要的操作。高级别胶质瘤患者术后似乎更容易出现脑脊液循环障碍。因此,在可行的情况下,AIT入路应该是受欢迎的,因为它允许外科医生容易地进行m3VC。
参考资料:DOI: 10.3171/2020.6.JNS20524.

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号