基因治疗和相关的生物治疗有望成为神经肿瘤学领域的新领域,因为它们协同的作用机制提供了程度的局部选择性,与手术切除、化疗和放疗等其他可用的治疗方式截然不同。脑膜瘤的基因治疗应用是相当新的,只有少数的临床前研究。
脑膜瘤替代治疗策略的基本原理
手术是治疗脑膜瘤的主要手段,大多数此类肿瘤可以通过手术轻松、顺利地切除,且预后良好。尽管总体结果良好,但由于脑膜瘤的内在生物学特性或难以定位,一些患者的治疗尝试失败。如果随访时间足够长,大多数脑膜瘤在切除后复发。辅助治疗如放射外科手术和放射治疗是合适的,但也有局限性和副作用。化疗是略微合适的,并作为一种抢救治疗的情况下,失败了其他可用的治疗选择。基因治疗是脑膜瘤治疗的一种有吸引力的新策略。潜在的应用领域有(1)复发性脑膜瘤,(2)难以治疗的局限性脑膜瘤,(3)多发脑膜瘤,(4)高危患者的脑膜瘤,(5)转移性脑膜瘤,以及(6)对传统治疗方法没有反应的非典型或恶性脑膜瘤。
基因治疗概论
基因疗法是指将遗传物质(DNA或RNA)引入人体细胞进行治疗的实验性疗法。这一领域较初是通过替换或替换缺失或改变导致疾病的基因而开始的。在媒介设计和治疗病毒学方面的进展,以及对分子肿瘤生物学的进一步了解,已将这一较初的概念扩展到许多有前途的战略。目前基因治疗在治疗脑恶性肿瘤中的应用大致可分为三类:
1.常规基因治疗:利用载体传递治疗基因
2.病毒疗法:使用病毒直接或间接杀死肿瘤细胞(例如,通过直接的细胞溶解或传递自杀基因)
3.免疫疗法:利用基因疗法来刺激身体的自然能力来攻击癌症。此外,基因治疗调节系统反应,如控制血管生成或实现化学保护是用于其他系统性癌症。
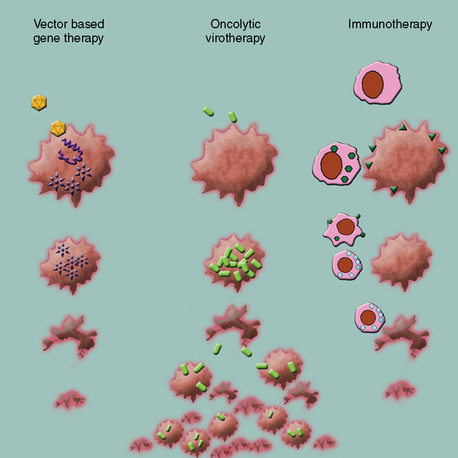
图示:目前基因治疗应用于治疗脑恶性肿瘤分为三类。基于载体的基因治疗旨在将治疗性基因导入肿瘤细胞。病毒治疗的目的是杀死肿瘤细胞,免疫治疗的目的是刺激身体的自然能力,以攻击癌症。
体内基因传递方法
将DNA或RNA导入靶细胞的方法有很多种。体外技术如直接微注射和化学(磷酸钙)或物理(电穿孔)转染方法在体内应用是不实际的。这使得“裸DNA”给药、脂质体基因传递和病毒介导的基因转移成为体内基因治疗应用的选择方法。注射“裸DNA”质粒已被证明可导致颅内基因表达。然而,在目前的技术水平下,表达效率很低,该技术在脑肿瘤基因治疗中的实用价值还有待观察。相比之下,脂质体基因转移已被确立为一种有希望的脑肿瘤治疗方式。良好的转移效率、顺利性、简单的设计,以及它们携带遗传物质、蛋白质、化学物质或物理颗粒进入细胞的独特能力,使这些人工脂质双层囊泡成为有用和令人兴奋的治疗工具。然而,病毒载体和治疗病毒是基因治疗领域的主流。
免疫疗法
癌症免疫治疗在恶性黑素瘤治疗领域得到了广泛的研究,2000年10月,恶性脑瘤免疫治疗工作组成立。与基因治疗和溶瘤病毒治疗一样,目前脑肿瘤免疫治疗研究的重点是神经外胚层系肿瘤,即胶质母细胞瘤和间变性星形细胞瘤。虽然这一策略转移到脑膜瘤目前仍是假设,但简要讨论一下当前的研究是值得的。
除了检测传染性或外来生物外,免疫系统还具有识别甚至消灭癌细胞的能力。要使这种反应合适,就需满足某些先决条件。肿瘤相关抗原(tumor-associated antigens,TAAs)需要表达,肿瘤环境需要“免疫相容”,因为某些肿瘤可以产生局部和全身的免疫控制状态。有证据表明,膜和细胞内的元素都可以作为TAAs。然而;尽管自然免疫反应具有很高的选择性,但在控制晚期、大规模癌症方面的效率却很低。患者免疫反应的较限似乎在不到100万个肿瘤细胞的范围内,与一个平均大小的脑瘤的数十亿个细胞相比,这是微不足道的一部分。在这方面,免疫治疗可以被定义为旨在增强对癌细胞的自然免疫反应的策略。免疫反应的两个分支,启动级联和执行效应阶段,都可以被靶向。
早期的免疫治疗尝试包括使用肿瘤裂解物和微生物制剂,如非特异性免疫激活剂,但收效甚微。随着对抗原表达和免疫调节机制认识的增加,抗肿瘤反应的方向转向高度特异性的刺激。主要策略包括使用细胞因子、肿瘤抗原脉冲树突状细胞的主动接种、22和使用体外培养和扩增的细胞毒性T细胞的过继免疫治疗。其中,细胞因子白细胞介素-2(IL-2)、IL-4、IL-12、IL-18、干扰素(IFN)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)和B7-2已被单独或联合使用,或作为细胞免疫治疗的佐剂。应用范围从直接外周输注和对流增强传递到体内细胞因子基因治疗和体外基因转移到抗肿瘤树突状或细胞毒性T细胞。的抗肿瘤接种包括血液单核细胞的收集、树突状细胞的体外分离和启动。树突状细胞被认为是较合适的抗原呈递细胞,与肿瘤细胞或肿瘤裂解液一起搏动的树突状细胞,一旦重新注入患者体内,就可以合适地启动辅助性T细胞,从而使细胞毒性T淋巴细胞产生合适的抗肿瘤反应。相比之下,过继性免疫转移侧重于肿瘤特异性效应细胞的体外扩增和再注入。几种细胞类型已被描述为潜在的过继免疫治疗:淋巴因子激活的杀伤细胞、肿瘤浸润淋巴细胞、细胞毒性T淋巴细胞等。
国际儿童神外专家Rutka教授交流:脑瘤分子靶向治疗前沿
INC国际神经外科医生集团旗下国际神经外科顾问团(WANG)成员James T.Rutka教授是加拿大神经外科医生,曾荣获2016年“加拿大更佳医生”称号。Rutka教授在儿科外科手术、脑瘤分子生物学、癫痫手术和外科手术教育杂志上发表了逾500篇文章。他还与神经外科专家合著以及修订教材级别书籍,对神经外科领域的发展做出的贡献,且在2013年担任国际神经外科杂志《Journal of Neurosurgery》主编,其对神经外科医生的研究具有指导性作用。Rutka教授在该杂志上公布的脑瘤前沿疗法靶向治疗引发了各方关注。
聚焦超声(FUS)BBB损害是一种通过局部、可逆和顺利的BBB损害增强治疗药物进入大脑的新策略。与其他常规BBB干扰方案相比,FUS干扰BBB的一个独特优点是选择性和区域性的通透性增加,从而增强了脑内的局部传递.这项技术需要经颅传送低频超声波,较终导致血脑屏障(Bbb)破裂。通常情况下,压力幅值小于1 mpa的10 ms的超声波曝光通常在频率为1hz的情况下重复20-30 s。通过使用低频率,长期性组织损伤的机会被较小化。这项技术可与磁共振成像结合使用,既可用于靶向目的,也可用于记录局灶性血脑屏障破裂,其表现为区域对比渗出。静脉注射脂质包封的全氟化碳微气泡(直径~1-5μm)的加入进一步降低了BBB中断的频率阈值,从而使用的频率更低、更顺利。十年前一次成功地证明了微泡辅助FUS损害Bbb的可行性。在没有微气泡的情况下,FUS Bbb损害效应并不明显,因为声功率要低两个数量级。当微气泡穿过毛细血管时,根据超声输入,它们会膨胀和崩塌。假设FUS会引起毛细壁的振荡和微气泡的浓缩,这反过来又会产生机械力,从而导致Bbb的开孔。此外,在没有血管损伤的情况下,微泡会发出与Bbb破裂高度相关的声音信号,这表明声学信号可以作为顺利的替代物。对Bbb的FUS损害的顺利性有很好的记录,其整体影响是短暂的和可逆的,没有明显的神经元损伤。
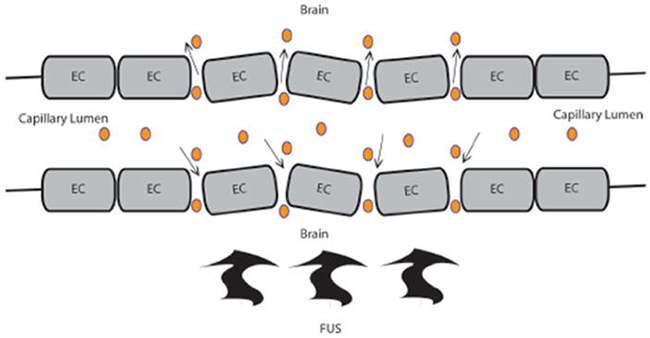
图:BBB破裂后增强血脑屏障传递的原理图。FUS提供低频超声波,引起微泡的机械振荡,导致内皮细胞(EC)紧密连接中断,导致血脑屏障(BBB)对药物的通透性增强。
多年致力于脑肿瘤靶向治疗、纳米技术、免疫治疗研究的James T.Rutka教授(表示,免疫治疗为那些丧失手术机会的患者提供了一个新治疗的机会。肿瘤免疫治疗将成为传统治疗手段之外较具价值和发展潜力的治疗手段,更有乐观者甚至预言这种治疗手段有望完全改变肿瘤的治疗现状。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号