脑膜瘤是常见的轴外原发性脑肿瘤,占全部原发性中枢神经系统肿瘤的三分之一。库欣首先将它们描述为一组起源于中枢神经系统硬脑膜覆盖物的肿瘤,它们可以在发现硬脑膜的任何地方出现。脑膜瘤中约有75-90%是世卫组织一级病变,通常进展缓慢。
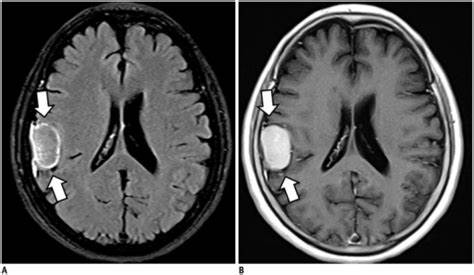
观察显示,患者之间的增长率和模式可能不同,即使全部患者都是世卫组织一级良性。疾病进展或症状表现较终可能需要对许多世卫组织一级脑膜瘤患者进行干预。由于肿块效应或邻近脑和颅神经的浸润,可能会出现的发病率。尽管全手术切除(GTR)长期以来一直是脑膜瘤的主要治疗方法,但它并不总是可能的,或者可能与相当高的发病率有关。因此,放射治疗长期以来一直作为STR(次全切除)术后的复发辅助治疗。此外,放射治疗在影像明确的脑膜瘤的初级治疗中也有作用,特别是在外科手术无法到达的区域,或者对于医学上不能手术或不希望进行手术的候选人。
随着我们继续对接受放射治疗的患者进行长期随访或作为手术的替代方案,很明显放射治疗是治疗国际卫生组织ⅰ级脑膜瘤各种表现的一种有价值的工具。包括立体定向放射外科(SRS)、分次外部射束放射疗法和使用质子的粒子疗法在内的多种治疗技术已经成功地用于这些肿瘤的治疗。本文将回顾放射治疗在国际卫生组织一级脑膜瘤中的应用。

STR后的放射治疗
在可能的情况下,全切除(GTR)仍然是国际卫生组织1级脑膜瘤较终治疗的基石。自20世纪50年代以来,脑膜瘤的切除范围通常用辛普森分级表。辛普森分级依赖于术中观察,并将切除质量按照1-5级进行分类。辛普森1切除去除全部肿瘤、相关硬脑膜附件和受累骨,而辛普森5级切除仅是简单的减压。在大多数研究中,辛普森1-3级切除被认为是GTR。成功获得GTR是全部级别脑膜瘤患者的重要预后因素,STR导致复发风险增加。在大约30%的病例中,由于肿瘤位置或接近神经或血管结构,GTR是不可能的;对于涉及蝶骨嵴、后颅窝、鞍旁区和视神经鞘的脑膜瘤如此。
许多对良性脑膜瘤进行长期随访的单个机构研究表明,单纯STR后5年局部进展率可能在37-62%之间,10年局部进展率可能高达52-全切。关于脑膜瘤患者是否应该接受的监测或放射治疗,仍然存在争议。一些研究表明,可以观察到少量残留的肿瘤,且PFS(无进展生存时间)率高。例如,苏格鲁2010年的一项分析辛普森4切除后发现81%的5年生存率。因此,患有高龄或多种共病和小残留肿瘤的患者可能不会复发,或者更重要的是,可能不会长到足以引起症状。
然而,其他人认为,特别是在肿瘤部位有可能出现症状的年轻患者中,需要辅助放射治疗。多项观察性研究已经证明了良性脑膜瘤STR后辅助治疗中分级EBRT的益处。在这些系列中,74-96%的患者在GTR单独治疗后的长期随访(通常为10年)中保持无进展。在没有辅助治疗的短串联重复试验后,PFS范围降至18–52%。辅助放疗可防止STR后局部控制失败,结果是68–全切的患者在长期随访中没有进展。
此外,某些系列研究表明,在STR影响良性脑膜瘤患者的特异性生存(CSS)后,辅助放疗可能对患者的生存有利。Condra和同事注意到STR影响良性脑膜瘤患者的特异性生存(CSS)。他们报告说,在切除的1级病变患者中,与GTR和STR相比,15年的CSS从88%下降到51%。他们注意到,在STR后增加放疗逆转了存活率的下降,在STR后接受EBRT治疗的患者中,86%的患者恢复到了15y CSS。值得注意的是,这项工作可能包括现在将被归类为世卫组织II级的患者,因此可能高估了辐射对较低风险患者的好处。然而,现代单病理学家分析了236个利用WHO 2007年分类的1级病变,发现STR是降低PFS(HR 4.18,P=0.007)和总生存率(OS)(HR 2.69,P=0.009)的重要因素。本研究的中位年龄为56岁,中位随访时间为75个月(24个月)。值得注意的是,本研究将GTR定义为Simpson 1或2次切除,并将Simpson 3次切除视为STR。
虽然大多数早期系列使用标准的外束放射治疗,并增加了边缘,但较近的系列使用立体定向定位的改进的成像和靶向能力,成功地以更高的精度治疗颅底肿瘤。这些研究显示,在短距离放射治疗后使用立体定向放射治疗(FSRT)或立体定向放射治疗的局部控制率很高。尽管考虑到晚期复发的风险,需要进行更长期的随访,但对超过1,100名患者进行3年、5年和10年随访的多份报告的初步结果显示,5年的局部控制率超过92-全切,10年的液相色谱率超过88-95%。这些研究中的患者通常采用1.8-2Gy的剂量级进行治疗,FSRT患者的总剂量为50.4-54Gy,而SRS患者的单个剂量级为13-16Gy。越来越多的长期证据表明,EBRT、FSRT和SRS是治疗STR后或手术困难患者的有吸引力的工具。
放射治疗作为主要治疗
当患者患有手术无法触及的肿瘤、医学上无法手术或更喜欢放射治疗而不是手术干预时,放射治疗已成为一种可行的替代方法。较初,放射疗法用于无法通过手术获得的肿瘤。例如,虽然较初对视神经鞘脑膜瘤进行手术切除,但高失明率与手术期间的视神经梗塞有关。因此,使用了标准的50–54Gy的分次外部放射治疗。已发表的数据表明,在超过90%的病例中,仅在初次放射治疗后,治疗肿瘤退化或保持稳定,并且在照射后可以保持视力。
类似地,海绵窦脑膜瘤的手术切除通常与颅神经病变相关,因此在单独放射治疗后,无论是标准分次外放射治疗还是立体定向放射外科治疗。这些经验导致了在其他地方用放射疗法对脑膜瘤的成功治疗,以及对那些在医学上不能手术或优选放射疗法而非手术切除的患者。
在广泛医学成像的时代,放射照相检测到的临床隐匿性病变的数量的增加也影响了SRS的使用的增加。许多这些无症状的病变小到足以进行的监测或用SRS进行治疗。从统计学上来说,这些偶发病变大多数是国际卫生组织一级脑膜瘤,成功治疗影像学定义的脑膜瘤表明放射治疗在大多数病例中可能是合适的。考虑到这些肿瘤的缓慢生长和晚期复发的可能性,长期随访是必要的,但是支持在影像学确定的脑膜瘤中使用初次放疗的证据正在积累。许多系列报告显示,仅用FSRT或仅用GKRS治疗的患者显示出相似的优良局部控制率,从5年时的89-99%到10年时的79-97%不等。公布的较大研究之一是对4500多名患者的回顾性分析,平均随访时间为63个月。它包括大约3000个影像学定义的脑膜瘤,仅用放射外科治疗,肿瘤控制,定义为体积缩小或大小稳定,为92.5%。
立体定向放射外科与分次外放射治疗
虽然较初的放射治疗经验包括标准的外照射治疗,为了尽量减少毒性,包括长期影响,临床医生开始使用更精确的靶向方法。这得益于成像技术的进步,包括磁共振成像(MRI)的广泛应用,以及钴-60机器、直线加速器、机器人直线加速器和质子治疗等立体定向传输技术的进步。20世纪90年代,脑膜瘤的标准外照射治疗报告陆续发表。然而,到2000年,大多数报告是关于FSRT和SRS的。
典型的SRS是为直径小于3厘米或体积约10立方厘米的肿瘤保留的。多项研究表明,疗效取决于肿瘤的大小。例如,DiBiase和他的同事报告说,小于10cm³的脑膜瘤患者5年无病生存率为91.9%,而大于10 cm³的脑膜瘤患者5年无病生存率为68%。此外,毒性很大水平上取决于大小。Pollack和他的同事报告了22年使用SRS治疗推定脑膜瘤的经验,肿瘤小于3.2cm³的患者并发症发生率为4.8%,大于9.6cm³的患者并发症发生率为22.6%。这些并发症包括颅神经缺损、头痛、偏瘫、新发/加重癫痫、囊肿形成和中风。
对于较大的肿瘤或那些接近剂量限制的正常结构,如视神经和交叉,分割放射治疗是较常用的。然而,越来越多的报道表明,多轴立体定向放射治疗使用了许多与SRS相同的平台。这些研究表明局部控制与单组分治疗相比具有可比性,其支持者认为副作用可能更少。
例如,Unger和他的同事报道了173例脑膜瘤患者,其中56%的患者接受了伽玛刀的单次放射外科治疗,其余的患者接受了多次放射治疗,通常是用CyberKnife进行2-5次。立体定向放射治疗的中位剂量为15 Gy,通常的方案为25 Gy,分为5个部分。多节段立体定向放射治疗的症状性水肿的两年精算风险为3.2%,SRS为12.5%。肿瘤大小大于4.9cm³也是症状性水肿的重要评估因子。然而,较近Conti和他的同事发表了229例用射波刀进行单次或多次放射外科治疗的患者,发现肿瘤体积、紧密的脑/肿瘤界面、非基底肿瘤部位和非典型组织学与治疗后水肿相关。治疗方式(单次与多次)与治疗后水肿无相关性。
随着我们对多节段放射外科长期疗效的随访和数据的不断积累,临床医生继续使用技术来更精确地提供标准的分次放射治疗。这包括利用立体定向框架和/或面罩、基于颅骨的基准点进行定位,以及较近的机载成像和CT扫描。
质子疗法形式的粒子疗法也被报道用于治疗良性脑膜瘤患者。布拉格峰阻止出口剂量的独特性质降低了正常大脑、颞叶、海马、耳蜗、脑干和垂体的整体辐射剂量。由于剂量减少,预计质子会降低神经认知能力下降的风险和二次肿瘤的过度风险(1.3vs每年每10,000名患者2.8人;P%3C0.002)64)。基于几个质子治疗系列的不完全切除或复发良性脑膜瘤,5年或10年的局部控制为88–全切,毒性可接受。
后期效果
如上所述,大多数良性脑膜瘤患者将实现长期肿瘤控制。因此,考虑与治疗相关的毒性和晚期效应是很重要的。许多人质疑放射疗法是否会导致良性脑膜瘤转变为更高级别的肿瘤。然而,恶性转化还没有明确地与放射治疗联系起来。很难确定放射治疗和非放射治疗的恶性转化率,因为对于复发或进行性脑膜瘤的亚组,自然史是转化到更高的等级.无论如何,良性脑膜瘤治疗后的转化相对较少。波洛克和他的同事发现,至少随访5年(中位随访9.2年)的脑膜瘤患者中,有2.2%在放射外科手术后转变为更高等级。
除了恶性转化,放射治疗也与继发性肿瘤有关。估计各不相同,但是对接受垂体腺瘤体外放射治疗的患者的长期随访也许能较好地说明这一点。Minniti和他的同事报道了426例垂体腺瘤患者,他们接受了手术和外照射治疗,治疗时间为5749人年。他们发现20年后患二个脑瘤的风险为2.4%。在11个二肿瘤中,5个是脑膜瘤。布林和他的同事报告了120名患者,平均随访时间为9年,发现2.7%的患者在10年和30年时发生了辐射诱发肿瘤(72)。这一比率可能会低于现代技术的更小的辐射场和/或放射外科。波洛克和他的同事较近对1837名患者进行了回顾,他们在良性肿瘤放射治疗后进行了11264个患者年的随访,发现15年内发生放射性肿瘤的风险为0.0%(95%可信区间为0.0-2.8%)。很少有关于放射治疗后放射性肿瘤的报道。
此外,接受脑部放射治疗的患者有其他晚期效应的风险,包括神经认知功能下降和垂体功能减退。对于脑膜瘤患者,放疗对长期神经认知功能的影响还没有很好的描述。已经表明,良性或低度肿瘤患者的神经认知功能与双侧海马的放射剂量有关。此外,大脑的其他区域也可能与神经认知有关。垂体功能减退的风险同样与接受的剂量有关。因此,继续努力将正常大脑和垂体的辐射剂量和范围降至较低可能会提高晚期效应的风险,但不会完全消除。正在进行的试验,如ROAM/EORTC-1308放射与非典型脑膜瘤手术切除后观察的试验,可能有助于描述我们脑膜瘤患者未来的神经认知结果。
结论
总的来说,良性脑膜瘤的放射治疗与良好的局部控制率和较小的毒性有关。放射治疗的晚期效应看起来很少,但却是可能的,进一步研究它们的流行程度将有助于确定治疗的风险和益处。未来的进展将集中于病理学的高级成像和分子检测,这有助于进一步区分复发的风险。这些信息不仅可以帮助我们确定哪些患者可以被观察到,还可以帮助我们确定哪些患者可能需要更高剂量或更大范围的放射治疗。
文章编译:INC国际神经外科医生集团

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号