听神经瘤一经发现便放疗,为何肿瘤仍然越长越大、压迫脑干和小脑;甚至还恶变升级,症状越来越严重,失去平衡、突聋;放疗失败后还能手术吗?手术风险会增加吗?本文对这样的多则病例进行了详析。
听神经瘤放疗失败案例
典型病例1:放疗后快速增长,直到压迫脑干
患者,女,58岁,右耳听力下降、耳鸣、头晕3年,初期MRI显示右侧管内型肿瘤略微突入桥小脑角区(图20-1A)。患者接受边缘剂量12.3Gy伽马刀治疗,每年复查一次MRI。放疗2年后发现脑桥小脑角肿瘤轻度增大(图20-1B)。随后患者出现全聋、头晕加重和共济失调。立体定向放疗后三年MRI显示肿瘤增大、压迫脑干(图20-1C)。放疗专家观察3年后接受手术。
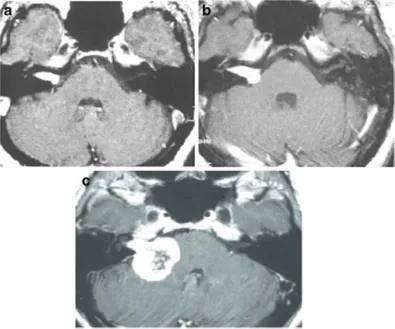
图1:A.轴位增强MRI显示右侧内听道内肿瘤,均匀强化(伽玛刀治疗前);B.轴位增强MRI显示肿瘤向脑桥小脑角生长(伽玛刀治疗2年后);C.轴位增强MRI显示肿瘤进一步生长压迫脑干和小脑(伽玛刀治疗3年后),肿瘤中心未强化
典型病例2:肿瘤持续增大、囊肿形成,耳聋、瘫痪
一名29岁女子初期出现身体不平衡和不稳定。核磁共振成像显示右侧有一个30毫米的病灶,有实性和囊性成分(图2a)。患者在诊断后立即接受了放疗。8个月后进行的随访MRI显示肿瘤的实性部分轻微增加,但囊性部分扩大(图2b)。她接受了立体定向囊肿穿刺引流,没有明显好转。在接下来的随访期内,肿瘤和囊肿继续增大,患者因不平衡恶化而变聋,且只能坐在轮椅上。患者随后接受了显微外科手术切除肿瘤经迷路的方法。由于肿瘤包膜和脑干之间存在严重粘连,因此进行了次全切(图2c)。手术后,面神经功能正常,病人好转到行走状态。
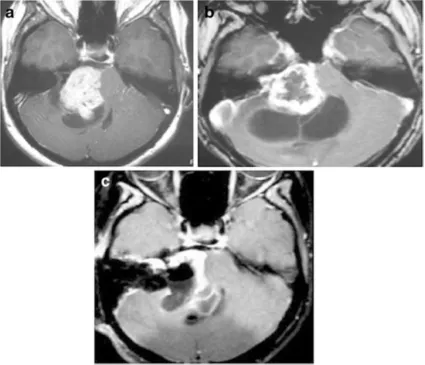
图2:29岁女性。a增强后轴向核磁共振显示右侧中等大小的肿瘤,不均匀强化压迫脑干。肿瘤具有实体和囊肿部分(在直线加速器治疗之前)。b增强后轴向MRI显示肿瘤实体部分轻微生长,囊性部分增大(直线加速器治疗后8个月)。肿瘤缺乏中央强化。c术后增强轴向MRI显示肿瘤的一小部分残留
其他放疗失败案例
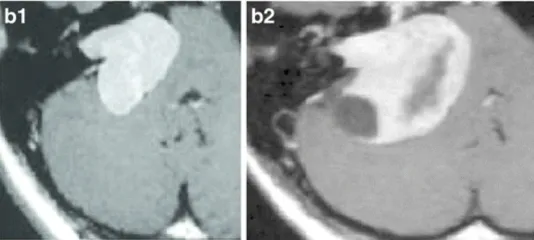
下图显示了放射治疗失败的其他病例,与这些患者相比,这些患者表现出更快的肿瘤再生长和更严重的临床症状(图3a–c)。由于脑干受压增加,这些病例都需要在伽玛刀治疗后3年内进行显微手术切除。图3d–f展示了立体定向放射治疗(SRT)之后的一些放射学变化。
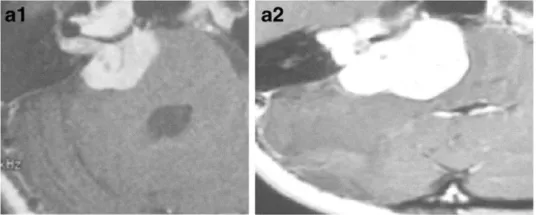
a-38岁女性。a-1增强后轴向MRI显示右侧中等大小的肿瘤(伽马刀治疗前)。a-2增强后轴向MRI显示肿瘤生长压迫脑干和小脑(伽马刀治疗后2年)。
b-22岁女性。b-1增强后轴向MRI显示右侧中等大小的肿瘤(伽马刀治疗前)。b-2增强后轴向MRI显示肿瘤进一步生长压迫脑干和小脑(伽马刀治疗后3年)。肿瘤缺乏中央强化,可见小囊肿形成。
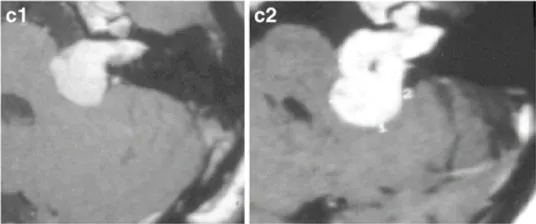
c-28岁女性。c-1增强后轴向MRI显示左侧中等大小的肿瘤,均匀强化(伽马刀治疗前)。c-2增强后的轴位MRI显示肌内和肌外部分的生长(伽马刀治疗后2年)。
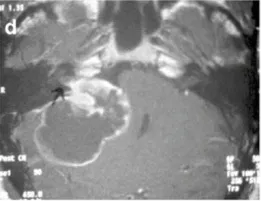
d-44岁女性。增强后轴向MRI显示右侧中等大小的肿瘤,有明显的囊肿形成(伽马刀治疗后2年)。
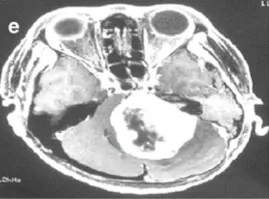
e-36岁女性。增强后轴向磁共振成像显示左侧较大肿瘤,在不适当的三次伽马刀治疗后明显压迫脑干。
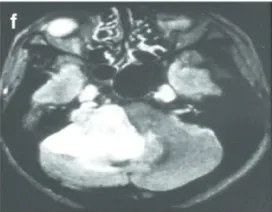
f-42岁男性。FLAIR轴向磁共振成像显示右侧大肿瘤,伽马刀治疗后小脑明显受损
INC国际教授听神经瘤成功案例交流
“我要保面、全切、保听”——大学教授听神经瘤两次突聋后,还能实现吗?
【INC巴教授全程手术纪实系列】八旬奶奶较大听神经瘤终获全切,如愿厮守老伴
北京天坛医院手术纪实——INC巴教授成功为一名听神经患者顺利全切手术
目前中小型听神经瘤治疗策略主要有3种,包括随访观察、手术和放射治疗。过去20年接受立体定向治疗(stereotactic radiation therapy,SRT)者逐渐增加,接受手术者逐渐减少。20世纪90年代初以来几种聚焦束SRT包括伽马刀(Gammaknife,GK)、赛博刀(CyberKnife,CK)诺力刀和质子刀已应用于控制听神经瘤生长。随着计算机技术进步和更精确靶向定位,SRT已被广泛应用于治疗听神经瘤。尽管具有上述优势,仍有少数听神经瘤患者放疗后再增长,如何治疗这些患者目前仍有争议。尽管再次放疗可能增加不良风险且再次失败,仍有些患者接受两次或多次放射治疗。另一方面,随着显微外科技术的发展,听神经瘤手术结果逐步好转。2016年相关报道对放疗失败者进行手术干预,74例SRT失败者予以挽救性手术,发现术后并发症风险增加。听神经瘤放疗失败后再手术,手术风险大吗?
上文失败案例均来自国际期刊《Neurosurgical Review》上,一代神经外科教授、INC国际神经外科医生集团旗下国际神经外科顾问团成员(WANG,World Advisory Neurosurgical Group)Takanori Fukushima教授发布的这样一则研究报道《Surgical management of vestibular schwannomas after failed radiation treatment》,报道回顾性分析了19年(1995-2013年)期间在某机构接受SRT治疗后出现再生的听神经瘤(vestibular schwannomas,VS)患者。研究的目的是记录SRT后肿瘤再生长或恶化或一次出现的症状的发生率,并讨论SRT失败的患者与手术治疗SRT失败的连续39例患者的手术策略。


评估临床症状、随访时肿瘤再生长、术中发现和手术结果。其中92.3%的患者在SRT后表现出稳定的肿瘤生长。5.1%的患者肿块轻微增大的患者因出现无法忍受的面部疼痛而接受了手术切除。其中SRT之后恶化或新出现的症状有耳聋(41%)、头晕(35.9%)、面部麻木(25.6%)、耳鸣(20.5%)、面神经麻痹(7.7%)和面部疼痛(7.7%)。术中所见证实了肿瘤块的纤维性改变、囊肿形成和肿瘤包膜的棕黄色或紫色变色。69.2%的肿瘤包膜与颅神经、血管和脑干发生严重粘连。
此外,在全部病例中,面部神经更加脆弱。33.3%的患者达到了全切除(GTR),35.9%的患者达到了近全切除(NTR),30.8%的患者达到了次全切除(STR)。术后19.4%的患者出现新的面神经麻痹。研究结果表明,SRT失败的VS患者,无论是肿瘤进展还是临床症状恶化,其与神经血管结构的粘连率都会增加,并可能出现放射影响的神经乳头瘤。放射治疗失败的肿瘤的挽救手术更加困难,并且具有更高的术后并发症风险。根治性全切除术可能不可行,需要考虑保守性次全切除术以避免新的神经功能缺损。
SRT是听神经瘤患者优选治疗方案吗?
过去20年越来越多的听神经瘤患者接受SRT治疗,但听神经瘤SRT后除个别肿瘤轻度缩小外,余者长期带瘤生存,需要密切随访、尽早发现肿瘤复发及神经症状加重。另一方面,多数接受手术者因肿瘤全切或近全切除而获得治愈。与之前的SRT报道相比上述的研究显示很多病例SRT后立刻出现新发症状或原有症状加重,如耳聋、面部麻木或感觉减退、面瘫及面部疼痛等。患者接受SRT治疗时,告知上述风险很重要。另外一个虽然少见但需提及的事实是38例患者在SRT后出现肿瘤恶变。
听神经瘤患者接受SRT治疗副作用
众所周知,2%~45%听神经瘤患者在SRT后6~12个月内会出现暂时性肿瘤增大。Pollock等报道SRT后肿瘤增大的平均时间是9个月、平均增大体积75%3。他们认为在此期间出现新的神经系统症状多为暂时性、无须治疗即可自行好转。因此,SRT后至少观察随访3年,除非出现严重症状才进行提前手术干预。结果发现,既往报道SRT和挽救性手术的平均间隔时间为32.1个月(19.2~46个月),该报道为45.1个月(8~240个月)。
据报道放疗失败、肿瘤增大者不足10%。放疗后再手术适应证:出现小脑性共济失调、颅内压升高、伴随肿瘤生长症状逐渐加重(即使在暂时性肿瘤增长阶段)。分析该报道研究人员之前报道的39例听神经瘤接受过一次或多次SRT后再次手术资料发现,放疗后因不同原因要求再手术者比例越来越高:1995-1999年只有2例(0.8%),2000-2005年达到8例(2.7%),2006-2013年达到64例(8.9%)。这种趋势可能是由于放疗应用越来越广甚至滥用所致,也可能是随着随访年限增加导致放疗失败病例越积越多。虽然部分病例SRT后肿瘤以稳定速度持续增长,但大约10%病例SRT后肿瘤静息多年后快速生长。已有文献强调有限随访时间可能存在风险,像听神经瘤这样的良性肿瘤至少需要随访15~20年才能确定治疗效果。现有长期随访研究似乎提示SRT可能是一项有前途、有价值的技术,但对这种生长缓慢的肿瘤目前设定的随访时间仍嫌太短故难以确定其疗效。
放疗失败后手术难度大吗?
多数学者认为听神经瘤放疗后再手术比直接手术难度更大,由于神经与肿瘤粘连导致面神经更难分离、肿瘤界面难以定位,再次放疗增加了脑神经损伤、脑积水、脑水肿或脑坏死的风险,此外初次放疗失败后肿瘤可能对放射线具有更强的抵抗力、对再次放疗不敏感。综合考虑这些情况,作者建议对大多数放疗失败者实施挽救性手术。
2012年Gerganov等也发现放疗失败再手术者术后面神经功能障碍比例更高38。Wise等回顾分析了37例SRS失败者,他们进行了一项大型多中心病例对照研究,比较放疗和非放疗听神经瘤患者,大约77%术前面神经功能正常者挽救手术后保留了面神经功能,全部切除和近全切除分别为49%和27%。随着放疗后手术经验增加,手术策略也变得更加保守以便保留功能。
放疗失败后手术难度在哪里?
研究还发现放疗后出现各种变化,肿瘤包膜与脑神经、脑干和血管之间粘连较常见;虽然N-VS(non-radiated VSs无放疗听神经瘤)患者也能看到粘连,但R-VS(radiated VS有放疗听神经瘤)粘连更厚、更紧密、更难分离(图20-2A、B);有时难以建立肿瘤-神经分离界面。此外,R-VS肿瘤周围蛛网膜比N-VS更厚、更不透明、更粘连。脑神经软化棘手,无法顺利地从肿瘤分离出来神经。小脑水肿、表面组织变脆。肿瘤本身变化也导致手术更复杂,肿瘤表面变黄变硬,包膜下出血导致肿瘤变成紫色,肿瘤组织也变硬变韧。肿瘤中心纤维化,导致增强MRI时该区域不强化。并非全部病例均有上述变化,但放疗至手术间隔时间越长,这些变化越常见。除了脑水肿和囊性变之外其他变化在MRI上无法显示,只有术中才能确认。其他文献也报道了放疗后肿瘤周围神经血管变化情况。目前尚不清楚这些变化是否只发生在听神经瘤接受SRT治疗者,但即使采用低剂量照射(小于10Gy),预计也会发生类似组织变化。与未放疗相比,放疗后脑神经是面神经损伤后功能很难恢复。
研究发现放疗后的面神经变软、变脆、与肿瘤粘连更紧。另外,面神经监测也提示即使轻柔操作,放疗后的面神经也比N-VS组的面神经更容易损伤,因此当术中面神经反应出现下降后术者应即可停止解剖面神经,这也许可以解释为什么R-VS组术后面瘫发生率高于期望值。
总结
与N-VS患者相比,R-VS患者因肿瘤纤维粘连、包膜纤维化、面神经软化等导致手术难度增大。术前影像学无法分辨上述变化,如果分离困难可考虑次全切除以便更好地保护面神经功能。SRT失败再次手术(近全切除或全切除)者需要随访更长时间观察肿瘤残留变化。目前给患者SRT方案前须详细告知放疗后可能出现肿瘤再生长、临床症状进行性加重、手术难度增加、全切率下降及面瘫风险增加等,需做好准备迎接这些挑战,接受放疗的患者应进行长期随访。由此可见,听神经瘤一次手术至关重要。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号