顶叶不像功能区、脑干或丘脑一样危险。但是对于顶叶的手术仍要重视,顶叶胶质瘤一旦手术不慎危害一个人的生活质量是简单的。顶叶的大体解剖很简单,但显微解剖异常复杂。现代神经肿瘤外科手术的目标是在保留神经功能的同时实现较大限度的肿瘤切除。大约30%的高级别胶质瘤和10%的低级别胶质瘤发生在顶叶。然而,很少有大型研究检查这些病变手术治疗后的结果。这些研究大多评估了位于顶叶下部以外的功能,如感觉和感受性语言。很少他们研究了从顶叶下小叶(IPL)切除肿瘤后的预后。
IPL位于颞枕交界处,是大脑连接的重要枢纽。它包含皮层和皮层下结构,这些结构起着至关重要的作用,是那些与语言有关的功能。这些结构包括皮质缘上回和角回(分别为SMG和AG),以及皮质下白质通路,如上纵束的颞顶部(SLF-tp)、SLF组分II和III(SLF-II和-III,或外侧裂语言网络的前段),弓状束(AF)和额枕下束(IFOF)。尽管如此,IPL的功能和结构组织表现出特别高的可变性,这就需要在肿瘤切除时进行功能定位。
脑胶质瘤治疗的首要目标是较大限度地切除肿瘤,同时保持功能状态。考虑到胶质瘤的结构和功能,从IPL切除胶质瘤预计会带来患者发病的,是在语言功能方面。与其他大脑区域一样,通过在术中进行清醒的刺激定位,这种风险可以被较小化。然而,到目前为止,只有少数病例系列和病例报告研究了IPL肿瘤切除术后的功能语言结果。
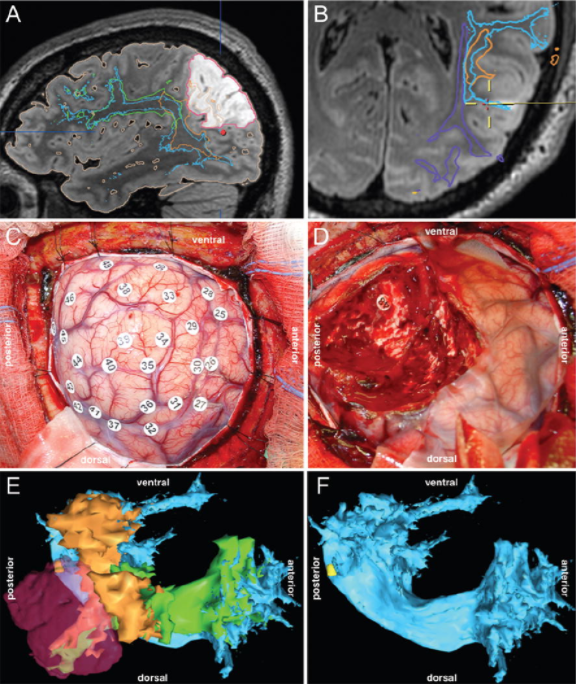
图示:少突胶质瘤(II级)。术前矢状位(A)和轴向(B)FLAIR序列显示一个非增强性病变。术前容积FLAIR磁共振成像上叠加了HARDI剩余引导qball纤维束描记术。切除前进行皮质刺激标测(C)。皮层刺激部位(用数字标记标记)均不干扰语言功能。切除至皮层下刺激标测(D)确定的功能边界。刺激标记部位(48号)可引起缺氧。该部位的立体定向坐标被保存,随后从神经导航系统中检索。患者左半球白质束(E)的三维显示,显示AF(浅蓝色)、SLF(绿色和橙色)以及肿瘤体积(紫色)。如图所示,病变延伸到房颤的后表面。呈现(F)描绘了48号位点(黄色)的位置,与房颤后部相对应。
语言主导型IPL包含几个对语言功能至关重要的皮层和皮层下结构。很少有报告描述了从该脑区切除固有肿瘤后的语言发病率。切除这些病变是顺利的,但不是无风险的。一项研究观察到16.7%(24人中的4人)的患者出现了新的长期语言缺陷神经胶质瘤IPL切除。这种新的语言缺陷率略高于我们从其他功能结构肿瘤切除术后观察到的。这里观察到的新的术后语言缺陷率与其他类似研究报告的相似,这些研究指出14%的患者术前语言缺陷,21%的患者术后长期语言缺陷。在这项研究中,新的术后语言障碍可以用许多可能的因素来解释:全部4例新的语言障碍都涉及伴有广泛病灶周围水肿的高级别肿瘤。此外,在4名患者中的1名患者中进行了短串联重复序列,他们也没有进行清醒语言映射(在另外3名患者中进行了GTR和清醒语言映射)。在这4名新出现术后语言障碍的患者中,有1名出现术后扩散受限。4名患者中有3名接受了术后放射治疗,全部患者均接受了GTR治疗。术后6个月,4名患者中有3名出现肿瘤进展。因此,新的术后语言障碍可能是由于延迟的肿瘤浸润、水肿、辐射效应和医源性损伤等因素导致的语言通路功能障碍造成的。值得注意的是,16.7%的患者(24例中的4例)出现了新的术后语言障碍,而62.5%的患者(8例中的5例)出现了术前语言障碍,手术切除后语言功能恢复正常。
尽管IPL结构对语言功能很重要,但在切除该脑区肿瘤后,其术后语言预后尚未得到很好的表征。研究分析了一组接受优势IPL胶质瘤切除术的患者。大约17%的患者(4 / 24)出现了新的、轻至中度的长期语言障碍,而63%的患者(5 / 8)在切除后,术前语言障碍得到了解决。术中语言映射是指导肿瘤切除的一个有价值的工具,而皮质语言阳性位点的缺失被发现可以评估术后完整的语言功能。患者年龄是与术后语言预后相关的其他因素,尽管本研究的样本量较小,限制了其检测可能与语言预后相关的其他因素(如高组织学级别)的能力。考虑到本研究中观察到的语言发病率,IPL胶质瘤的治疗应考虑切除,但切除应在术中定位的指导下,以减少发病率。进一步的手术发病率特征,特别是术后感觉、接受语言和认知功能方面的特征,对于更充分地描述IPL胶质瘤切除术的顺利性是必要的。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号