低级别胶质瘤属于中枢神经系统内胶质细胞癌性生长的亚型,以生长缓慢和恶性程度相对较低为特点。尽管侵袭性较低,这些肿瘤仍可能通过压迫周围神经和血管结构引发显著神经系统症状,且在部分病例中存在恶性转化风险。因此,对低级别胶质瘤实施及时且恰当的评估与管理至关重要。
除常见CT与MRI外,哪些先进及新兴技术有助于更深入了解胶质瘤?主要包括磁共振波谱成像(MRS)、灌注加权成像(灌注MRI)、弥散张量成像(DTI)、功能磁共振成像(fMRI)、正电子发射断层扫描(PET)、单光子发射计算机断层扫描(SPECT)及其他新兴成像技术等。
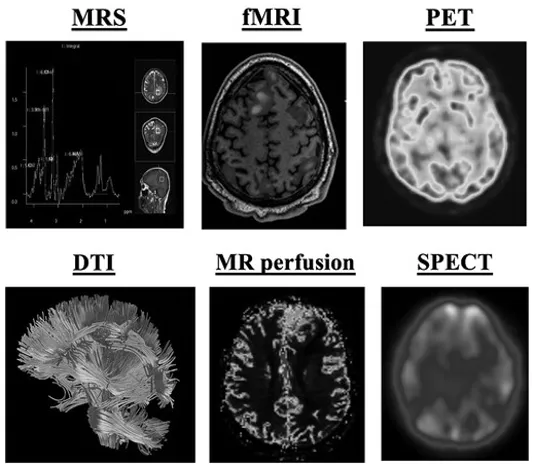
研究表明,多数高级神经影像技术可可靠区分低级别与高级别胶质瘤,而MRS与DTI可能进一步支持肿瘤分子亚型分类。PET最适用于肿瘤活检定位,fMRI与DTI在术前手术规划中价值显著,因能勾画肿瘤切除过程中需保留的重要功能脑区。
MRS、PET、SPECT及灌注MRI可用于监测肿瘤进展,因各自指标与肿瘤基础代谢活动密切关联。虽DTI与MRS均被证实可区分IDH突变状态,但组织病理学分析与基因检测仍是金标准。
总之,这些技术提供大量信息,成为神经科医生与神经外科医生管理低级别胶质瘤患者的重要工具。那么,这些不同检查技术有何区别?应如何选择?
胶质瘤分级与评估基础
胶质瘤简而言之包括低级别和高级别。“低级别”胶质瘤(对应1级和2级)涵盖预后较好的偏良性肿瘤;而“高级别”胶质瘤(对应3级和4级)包括恶性程度更高、通常需手术辅助放化疗的肿瘤。无论肿瘤级别或其他定义特征如何,所有胶质瘤均需全面评估、密切监测及恰当管理。
胶质瘤评估依托神经系统检查、生化检查、影像学检查,以及在获得活检标本情况下的组织病理学报告。所有这些方法对全面评估潜在胶质瘤的病理特征和进展至关重要。
自20世纪80年代初开始应用的磁共振成像,能够勾画病灶,帮助了解其位置、大小和生长模式。神经影像学最新进展使基于影像的评估更加强大,可提供病灶内部及周围区域的代谢活性、血管灌注、分子构成和组织分布等信息。这些序列信息共同为评估胶质瘤的潜在级别、分子亚型、进展可能性、手术最佳切除范围及总体预后提供见解。
胶质瘤常规影像检查
胶质瘤神经影像常规检查目前主要包括CT和MRI。这两种成像方法可相对清晰显示脑解剖结构特征及脑肿瘤病变形态学特征,如部位、大小、周边水肿状态、病变区域内组织均匀性、占位效应、血脑屏障破坏程度及病变造成的其他合并征象等。
在图像信息上MRI优于CT。CT主要显示脑胶质瘤病变组织与正常脑组织的密度差值,特征性密度表现如钙化、出血及囊性变等,病变累及部位、水肿状况及占位效应等;常规MRI主要显示脑胶质瘤出血、坏死、水肿组织等的不同信号强度差异及占位效应,并可显示病变侵袭范围。多模态MRI不仅能反映脑胶质瘤的形态学特征,还能体现肿瘤组织的功能及代谢状况。
点击阅读:【官方指南】2022年脑胶质瘤诊疗系列一:胶质瘤影像怎么看?
先进影像技术详解
1. 正电子发射断层成像(PET)
PET属功能性放射学技术,可实现静脉注射的正电子发射同位素的可视化。注射的同位素及其在体内的相对摄取情况为了解生理功能(包括血流和代谢)提供见解。在肿瘤学领域,PET被广泛用于肿瘤的定位和分级,以及追踪疾病进展和治疗反应。
首先,PET可支持潜在肿瘤的识别和分级。PET也被研究用于监测低级别胶质瘤的进展和预测生存期。
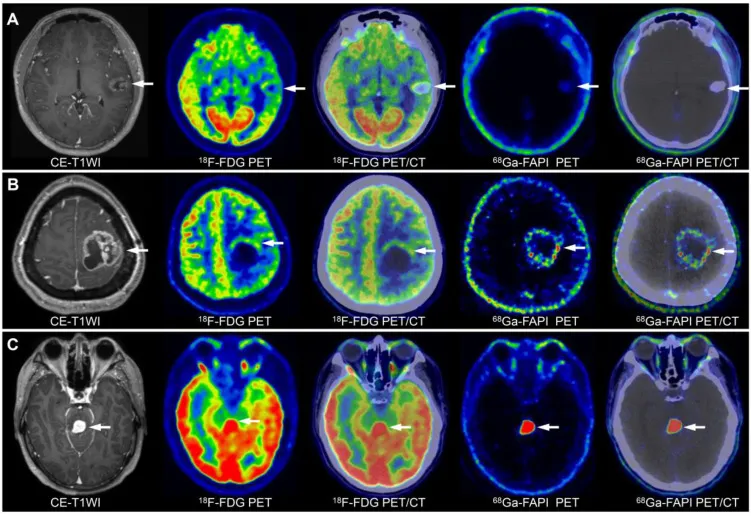
不同级别胶质瘤影像特征显示:A为低级别胶质瘤;B为三级胶质瘤;C为四级胶质瘤。
重要的是,PET已被证明是引导立体定向活检规划的重要成像方式。适当的目标选择对获取能准确指导后续管理的代表性组织样本至关重要。使用PET示踪剂可识别肿瘤中代谢活跃、含有高度增殖细胞的区域,为组织病理学分析提供最佳样本。然而,PET引导活检的主要局限是肿瘤需足够大才能被PET检测到(即直径>0.7cm),且需根据化合物半衰期协调示踪剂注射和扫描采集时间。
2. 弥散张量成像(DTI)
DTI是一种先进成像技术,利用水分子扩散在MRI图像上产生对比度。水分子扩散的模式有助于理解脑内白质和灰质纤维的分布情况,以及可能破坏正常对比分布的相关病变。DTI扫描提供一系列描述神经组织特性和水分子扩散特征的指标,包括纤维密度指数(FDI)、平均扩散率(MD)、各向异性分数(FA)和表观扩散系数(ADC)。
DTI在低级别胶质瘤评估中应用广泛。首先,通过DTI获得的指标可支持基于级别的胶质瘤分类。肿瘤中心的FDI和MD有助于区分低级别和高级别胶质瘤。除评估肿瘤级别外,DTI还有助于了解低级别胶质瘤的分子亚型,多项研究表明FA与肿瘤的IDH突变状态以及1p/19q联合缺失的存在相关。
DTI还可作为术前规划和术中神经导航的辅助工具,因能勾勒出白质纤维束的位置和完整性。这有助于规划手术入路,使外科医生能在最大程度切除肿瘤和保护神经功能之间找到最佳平衡。
INC巴特朗菲教授在国内学术交流时,曾为一名7岁基底节区胶质瘤患儿进行示范手术。为保护患儿运动功能,巴教授建议术前进行DTI重建,图像可显示运动纤维在肿瘤中的具体位置。这样主刀医生在手术时能更加小心,避免误伤运动纤维。最终手术结果如何,可点击阅读相关案例。
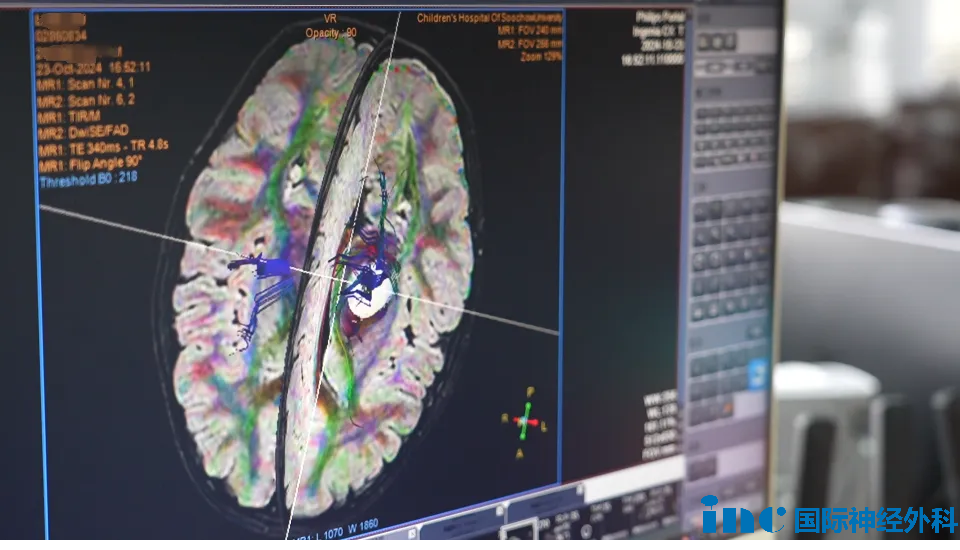
根据多项研究,使用DTI可能与术后更高的卡氏功能状态评分、更大的肿瘤切除范围和更长的总生存期相关。将DTI与MRI进行融合配准,可作为预测关键白质神经功能定位的方法,进一步支持规划过程和手术导航。当然,除纤维束示踪技术外,外科医生仍需依赖解剖标志、电生理评估和其他影像学技术来引导肿瘤切除,这一点至关重要。
最后,DTI也作为一种评估药物治疗反应的工具被研究。
3. 磁共振波谱技术(MRS)
MRS是一种先进神经影像技术,利用磁场根据发射的电磁信号的射频特性来分析被扫描组织的代谢成分。该技术于2000年代末被引入神经肿瘤学领域,用于区分肿瘤与假瘤性病变,并有助于深入了解潜在的胶质瘤分级。
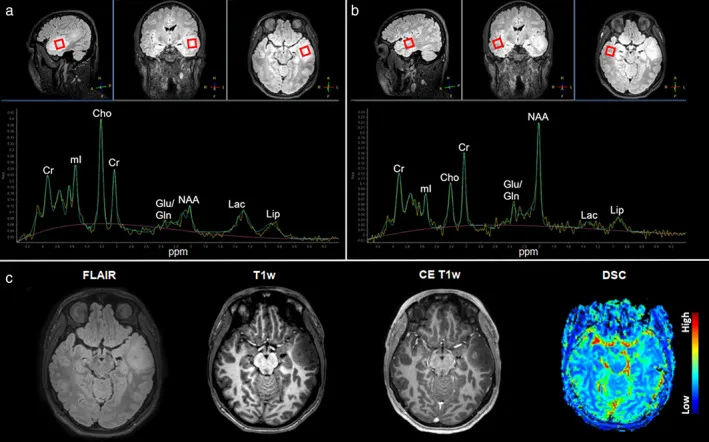
胶质母细胞瘤MRS表现显示典型代谢特征。
此外,研究表明MRS可根据相应的NAA/Cho和NAA/Cr比值来区分胶质瘤和非胶质瘤病变。而且,MRS可能是一种引导立体定向组织活检的可行手段,因为具有高Cho/NAA比值的肿瘤区域被认为最适合进行组织病理学评估。
MRS在评估肿瘤进展方面的作用也日益受到关注。一项研究显示,在替莫唑胺治疗的患者中,一年内病灶中心Cho浓度的降低与肿瘤体积的缩小相关,这凸显了MRS在监测化疗反应方面的价值。
此外,Cho/Cr测量值在区分疾病复发和放射性损伤、疾病复发和假性进展方面显示出有效性。但应注意,一项涵盖18项研究、445名患者的大型荟萃分析作者得出结论,MRS在鉴别胶质瘤复发与放射性坏死方面的诊断性能仅为中等。因此,MRS结果应与其他影像学技术的结果相结合,以确保高诊断准确性并为临床决策提供适当支持。
4. 灌注磁共振成像(MR perfusion)
灌注MRI是一种涉及静脉注射钆对比剂后进行一系列T2加权成像的技术。对比剂在病灶内的积聚反映了其血管生成程度,揭示了关于病灶可能病理特征的有价值信息。因此,它在描绘脑肿瘤背景下的组织血管化和血管新生方面特别有用。
对于胶质瘤,灌注MRI已被证明能够以低至中等准确度区分低级别和高级别胶质瘤。重要的是,该技术也被研究用于预测低级别胶质瘤的恶性转化。然而,由于缺乏标准化参数且易受成像伪影影响,其预测价值可能有限,不应作为监测疾病进展的独立技术。
5. 功能磁共振成像(fMRI)
fMRI是一种利用血氧水平依赖信号来绘制全脑耗氧量图谱的神经影像技术。该技术已广泛用于研究,以更深入地了解大脑的功能分区以及不同脑区之间的连接。然而,fMRI在临床实践中并不常用,主要原因是BOLD信号存在较高的受试者内和受试者间变异性,并且缺乏标准化的采集和分析技术。
尽管存在这一重要局限,fMRI仍可能在术前手术规划中提供一些益处。最后,静息态fMRI的独立成分分析在区分胶质瘤与正常组织方面显示出高成功率,为进行术前fMRI提供了额外依据。然而,与许多其他成像技术不同,fMRI尚未被证明在胶质瘤分级和肿瘤监测方面有益处。
6. 单光子发射计算机断层成像(SPECT)
SPECT与PET类似,是一种核素成像方式,可用于评估组织灌注和代谢摄取。总体而言,SPECT在低级别胶质瘤评估中的价值不如其他技术研究得深入。与讨论的大多数成像方式一样,SPECT已被证明可以区分低级别和高级别胶质瘤。
SPECT也可能是一种评估和预测低级别病变进展的可行工具。此外,该技术在区分肿瘤进展和放射性损伤方面表现出高准确度。关于该主题的一项系统评价得出了类似结论,即SPECT是区分肿瘤进展与放射性损伤最准确的成像技术。
最后,SPECT可能是一种有用的随访方法,对于已接受低级别胶质瘤切除的患者,定期的SPECT监测可能是常规临床随访的有价值辅助手段,但需理解的是,与PET一样,它会使患者受到额外的辐射。
结论
目前有多种先进的神经影像学技术可以促进和改善低级别胶质瘤的管理。这些技术目前在胶质瘤的识别和分级、术前和术中规划、疾病监测以及治疗反应监测方面具有意义。
目前,没有足够的证据表明某些技术优于其他技术,在实践中,多种技术的联合使用可能提供最可靠和一致的结果。上述大多数技术在区分低级别和高级别胶质瘤方面显示出可靠的结果,但在确定具体级别(即1-4级)方面成功率较低。关于是否以及在多大程度上采用这些技术进行患者评估和管理的决定应由神经外科医生来主导。
参考资料:The use of advanced neuroimaging modalities in the evaluation of low-grade glioma in adults: a literature review. DOI: 10.3171/2023.11.FOCUS23649.

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号