视路胶质瘤,字面意思就是生长在视神经的胶质瘤。那么事实上,视路胶质瘤(optic pathway glioma, OPG)是发生于视神经和/或视交叉的低级别星形细胞肿瘤呈散发或见于1型神经纤维瘤病(neurofibromatosis type 1. NF1)患者。
关于视路胶质瘤这个频繁发生在小朋友脑部的肿瘤,希望可以引起各位家长的重视,不仅仅因为它是胶质瘤,还因为它的占位可能会引起视力丧失。
OPG约占脑部胶质瘤的2%,通常生长缓慢,主要见于儿童,90%的患者在20岁前确诊,75%的患者在10岁前确诊。
OPG的症状和体征通常历经数月至数年,取决于肿瘤位置。
视路胶质瘤究竟对小朋友有什么影响呢?
01 眼球突出、斜视
眶内肿瘤大多表现为眼球突出,较少见的表现包括斜视以及与点头性痉挛类似或相同的症状(钟摆型或非共轭眼震、斜颈和点头)。单侧视力障碍是相对少见的主诉症状,这可能是由于这些患者发病时年龄较小。眼底镜检查可能发现视盘水肿和/或萎缩所致苍白。
02 视野缺损、视力下降
视交叉和下丘脑胶质瘤即使一般为高分化、低级别(大多为毛细胞型),也常表现为大肿块。视交叉病变患者的主诉通常是视野缺损、视力下降。患者就诊时也可能存在梗阻性脑积水。
03 生长缓慢
下丘脑胶质瘤患者可出现间脑综合征,婴儿患者表现为进行性消瘦、生长迟滞、高度警觉。
04 内分泌异常
10%-20%的OPG患者因下丘脑受累而出现内分泌病变。最常见的表现是下丘脑-垂体-性腺轴受累所致性早熟,在合并视交叉OPG的NF1患儿中,其发生率高达39%。因此,应筛查所有视交叉肿瘤患儿有无内分泌异常。
05 性早熟
患者的主诉症状往往因有无NF1而异。散发性OPG患者更可能出现颅内压增高和脑积水征象,而NF1相关OPG患者则更可能出现性早熟。
当孩子有什么样的表现,就需要考虑OPG了呢?
当孩子出现了原因不明的视力丧失、单眼或不对称眼震、间脑综合征或者视神经萎缩。需要前往医院立即就诊,并且做MRI增强扫描,显示出全段视神经和视路,来确诊。与CT相比,MRI还能更清楚地显示下丘脑受累。对于有明确肿瘤并接受连续随访的患者,MRI平扫评估肿瘤大小的准确性与MRI增强扫描相似。
在MRI影像中,有3种典型表现:
●视神经管状增厚和/或迂曲
●鞍上肿瘤伴相邻视交叉或视神经受累
●鞍上肿瘤伴视束受累
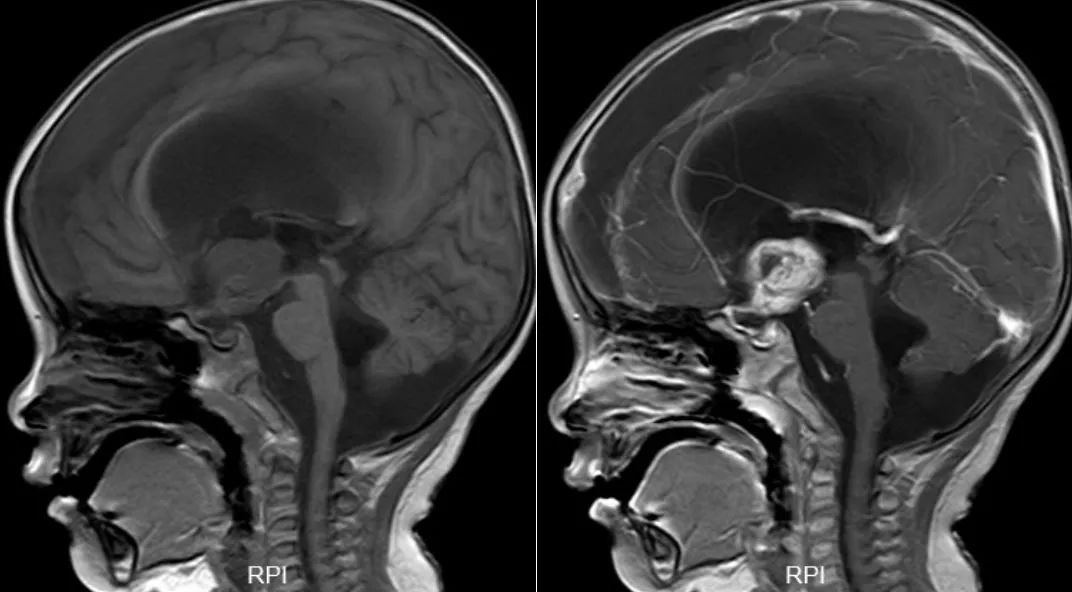
当然,由于部分区域生长的肿瘤种类较多,医生通常会进行鉴别诊断,那么鉴别诊断的依据如下:
下丘脑区域肿块的鉴别诊断包括颅咽管瘤、胶质瘤、生殖细胞瘤、畸胎瘤、淋巴瘤、朗格汉斯细胞组织细胞增生症和神经系统结节病。囊肿形成在OPG中并不常见,但可见于肿瘤延伸累及下丘脑区域的病例。鞍上肿块内存在囊肿和钙化则更提示成釉质细胞型颅咽管瘤,但不能据此确诊。
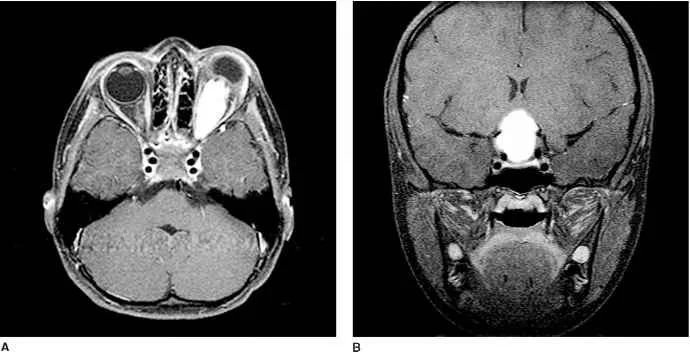
不伴明显视神经/视束受累的鞍上肿块不太可能为OPG,可能需要活检来确诊。采集的活检样本可用于分子检测,可能改变未来的治疗和预后。一项研究纳入72例非NF1相关OPG患者,均有活检样本用于分子检测,结果发现临床病程不良的患者(定义为放疗后病情进展、多线全身性治疗后病情进展、转移或致命疾病)有明显不同的临床表现和分子改变、通路激活和/或表达。最值得注意的是,KIAA1549-BRAF融合与更具侵袭性的疾病相关。
参考资料:
Alvord EC Jr, Lofton S. Gliomas of the optic nerve or chiasm. Outcome by patients' age, tumor site, and treatment. J Neurosurg 1988; 68:85.
Tenny RT, Laws ER Jr, Younge BR, Rush JA. The neurosurgical management of optic glioma. Results in 104 patients. J Neurosurg 1982; 57:452.
Benes V, Julisová I, Julis I. Our treatment philosophy of gliomas of the anterior visual pathways. Childs Nerv Syst 1990; 6:75.
Liu GT, Galetta SL, Rorke LB, et al. Gangliogliomas involving the optic chiasm. Neurology 1996; 46:1669.
Sutton LN, Packer RJ, Rorke LB, et al. Cerebral gangliogliomas during childhood. Neurosurgery 1983; 13:124.
Vajramani GV, Dambatta S, Walker M, Grundy PL. Multiple gangliogliomas of the optic pathway. Br J Neurosurg 2006; 20:428.
Listernick R, Charrow J, Greenwald M, Mets M. Natural history of optic pathway tumors in children with neurofibromatosis type 1: A longitudinal study. J Pediatr 1994; 125:63.
Listernick R, Louis DN, Packer RJ, Gutmann DH. Optic pathway gliomas in children with neurofibromatosis 1: consensus statement from the NF1 Optic Pathway Glioma Task Force. Ann Neurol 1997; 41:143.
Taylor T, Jaspan T, Milano G, et al. Radiological classification of optic pathway gliomas: experience of a modified functional classification system. Br J Radiol 2008; 81:761.
Miller NR, Iliff WJ, Green WR. Evaluation and management of gliomas of the anterior visual pathways. Brain 1974; 97:743.
WHO Classification of Tumours of the Central Nervous System, 4th ed, Louis DN, Ohgaki H, Wiestler OD, Cavenee WK (Eds), International Agency for Research on Cancer, 2016.
Jacob K, Albrecht S, Sollier C, et al. Duplication of 7q34 is specific to juvenile pilocytic astrocytomas and a hallmark of cerebellar and optic pathway tumours. Br J Cancer 2009; 101:722.
Yu J, Deshmukh H, Gutmann RJ, et al. Alterations of BRAF and HIPK2 loci predominate in sporadic pilocytic astrocytoma. Neurology 2009; 73:1526.
Whittle IR, Mitchener A, Atkinson HD, Wharton SB. Anaplastic progression in low grade glioneural neoplasms. Acta Neuropathol 2002; 104:215.

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号