INC国际儿童脑瘤专家、世界小儿神经系统专业杂志《Child's Nervous System》现任主编Concezio Di Rocco教授发表研究论文《ADAR2-editing activity inhibits glioblastoma growth through the modulation of the CDC14B/Skp2/p21/p27 axis》(ADAR2编辑活性通过调控CDC14B/Skp2/p21/p27轴抑制胶质母细胞瘤生长),以下是研究主要内容概述。
01 研究摘要
IV级星形细胞瘤(多形性胶质母细胞瘤,GBM)属人类最具侵袭性及致死性的肿瘤类型之一。ADAR2介导的A→I RNA编辑是脑组织必需的转录后修饰过程,但在GBM及星形细胞瘤细胞系中显著受损,其功能尚未明确。本研究证实,在星形细胞瘤中恢复ADAR2编辑活性可阻止体内肿瘤生长,并调控GBM中常失调的Skp2/p21/p27细胞周期通路。ADAR2脱氨酶活性为抑制肿瘤生长所必需。研究首次发现磷酸酶CDC14B是该通路的上游关键新型ADAR2靶基因:ADAR2对CDC14B前体mRNA的编辑提高其表达水平,进而降低Skp2蛋白水平,该机制在体外与体内模型均获验证。与正常脑组织相比,CDC14B的编辑率和表达水平从I级至IV级星形细胞瘤逐渐下降,在GBM中几乎缺失。
综上结论包括:(1)A→I RNA编辑对GBM发病机制至关重要;(2)ADAR2编辑酶是新型候选抑癌基因;(3)ADAR2或其底物可作为更安全、有效的GBM治疗新靶点。
02 研究结果
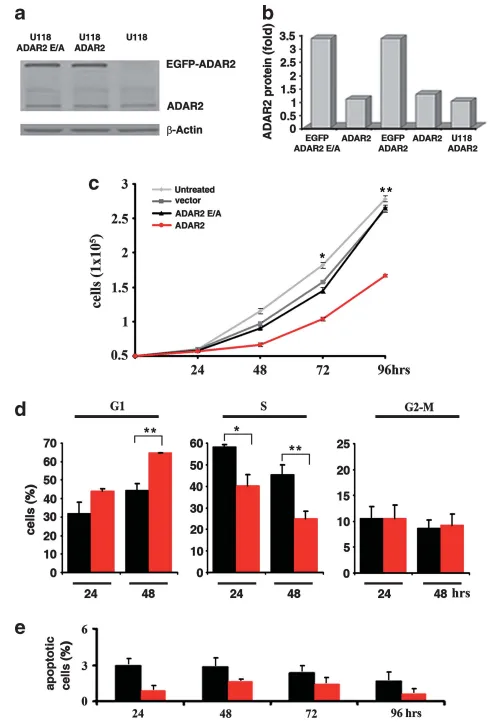
图1 ADAR2编辑活性通过调控细胞周期影响星形细胞瘤细胞增殖
(a) U118亲本细胞、ADAR2过表达细胞及酶失活突变体ADAR2E/A细胞的总蛋白免疫印迹检测ADAR2表达;(b) 以β-肌动蛋白作为内参,相对蛋白表达量以任意单位表示,以内源水平设为1;(c) 5×10^4 U118细胞增殖曲线:未处理(浅灰)、空载体(深灰)、ADAR2(红)及ADAR2E/A(黑)第1-4天结果。误差条表示5次独立实验标准差(Mean ± s.d., n=5),P < 0.05、P < 0.01 vs ADAR2E/A;(d) 5×10^4细胞BrdU/PI双标记流式周期分析(FACSCanto II):ADAR2(红)与ADAR2E/A(黑)接种后24-48h示例(Mean ± s.d., n=3),P < 0.05、**P < 0.01;采用Click-iT EDU试剂盒获得一致结果;(e) 5×10^4细胞第1-4天凋亡检测:ADAR2(红)与ADAR2E/A(黑)(Mean ± s.d., n=3)。
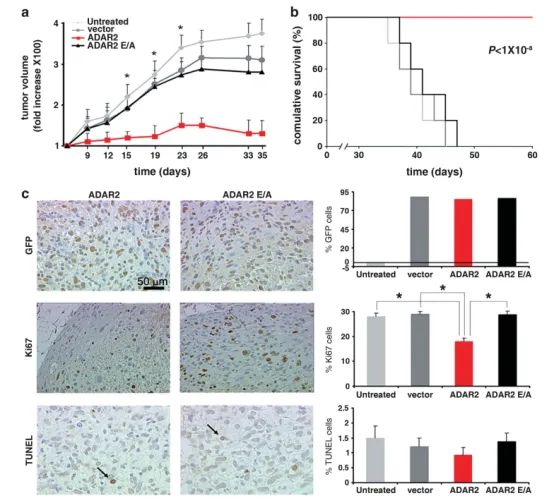
图2 ADAR2编辑活性抑制星形细胞瘤体内生长
(a) 2.5×10^6 U118亲本、空载体、ADAR2及ADAR2E/A细胞肿瘤生长曲线。肿瘤体积以首次测量值(设为1)的倍数表示(y轴),x轴为注射后天数(Mean ± s.d., n=20),P < 0.01 vs ADAR2E/A肿瘤;(b) 上述各组小鼠的Kaplan-Meier累积生存曲线;(c) 注射后15天(指数生长期)取瘤行免疫组织化学:左图示代表性视野,分别进行抗-GFP、抗-Ki67及TUNEL染色(箭头示凋亡细胞);右图示U118未处理(浅灰)、空载体(深灰)、ADAR2(红)及ADAR2E/A(黑)肿瘤中GFP、Ki67、TUNEL阳性细胞百分比(Mean ± s.d., n=10),P < 0.01。
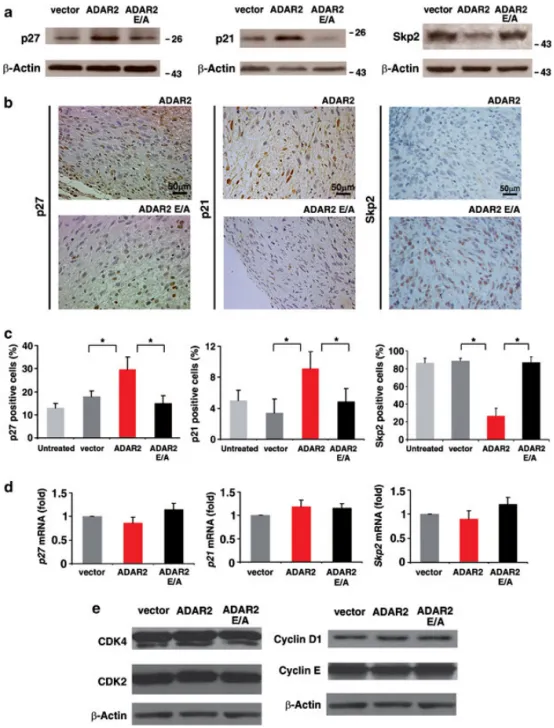
图3 ADAR2表达对p27/p21/Skp2通路的体内外分析
(a) 空载体、ADAR2及ADAR2E/A细胞总蛋白的p27、p21、Skp2免疫印迹;(b) 15天移植瘤免疫组化:ADAR2与ADAR2E/A肿瘤代表性视野(p27、p21、Skp2染色);(c) 移植瘤(15天)IHC阳性细胞百分比:未处理U118(浅灰)、空载体(深灰)、ADAR2(红)、ADAR2 E/A(黑)(Mean ± s.d., n=10),**P < 0.01;(d) qRT-PCR检测上述细胞系p27、p21、Skp2 mRNA水平(Mean ± s.d., n=4);(e) 空载体、ADAR2、ADAR2E/A细胞总蛋白的CDK4、CDK2、Cyclin D1、Cyclin E免疫印迹。
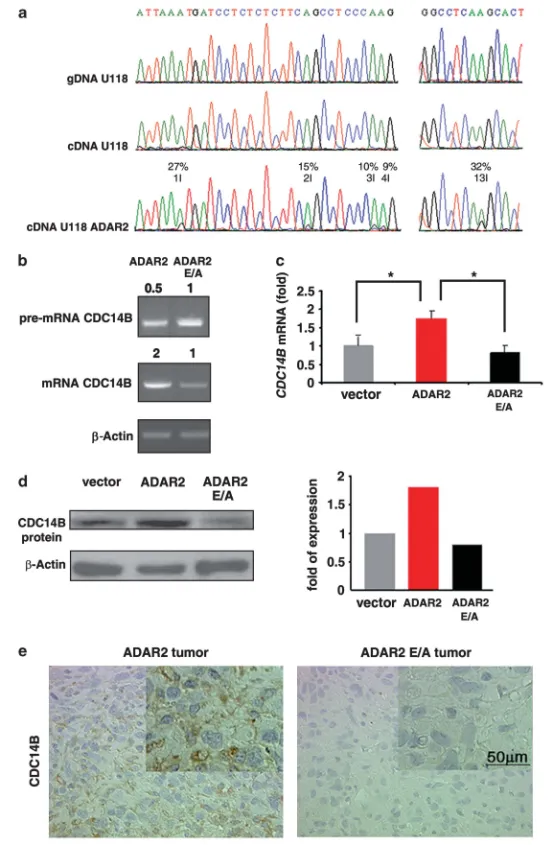
图4 ADAR2介导的RNA编辑在体内外调控CDC14B表达
(a) U118基因组DNA(gDNA)、U118亲本cDNA及U118-ADAR2 cDNA中CDC14B内含子7-8区域测序色谱图。编辑位点(1-4I、13I)呈A(绿)与G(黑)双峰,右侧标注编辑率;(b) 半定量RT-PCR检测CDC14B前体mRNA与成熟mRNA:ADAR2 vs ADAR2-E/A,表达量以ADAR2-E/A设为1的相对倍数表示,β-肌动蛋白内参;(c) qRT-PCR检测CDC14B mRNA:空载体、ADAR2、ADAR2-E/A细胞(Mean ± s.d., n=3),*P < 0.01;(d) 免疫印迹检测CDC14B蛋白(左)及光密度定量(右);(e) ADAR2与ADAR2-E/A移植瘤CDC14B免疫组化代表性视野。
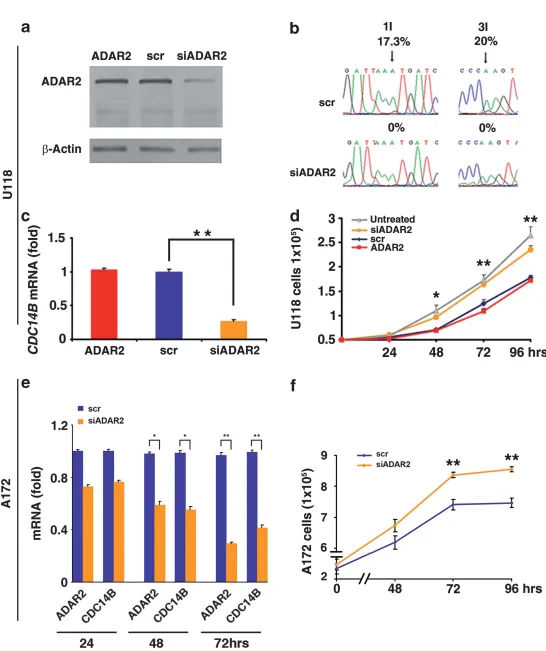
图5 ADAR2编辑上调CDC14B表达并调控细胞增殖
(a) ADAR2-U118细胞及其scramble(scr)或siADAR2稳定转染株的总蛋白ADAR2免疫印迹;(b) 内源性CDC14B转录本测序图,箭头示随机位点编辑率;(c) qRT-PCR检测CDC14B mRNA:ADAR2、scrADAR2、siADAR2组(Mean ± s.d., n=2),P < 0.01;(d) 增殖曲线:未处理U118、ADAR2、scrADAR2、siADAR2(Mean ± s.d., n=3),P < 0.05、P < 0.01 vs siADAR2;(e) A172细胞沉默内源ADAR2后24、48、72小时的ADAR2与CDC14B qRT-PCR(Mean ± s.d., n=2),P < 0.05、P < 0.01 vs scrADAR2;(f) A172 scramble与ADAR2沉默株增殖曲线(Mean ± s.d., n=2),P < 0.01。
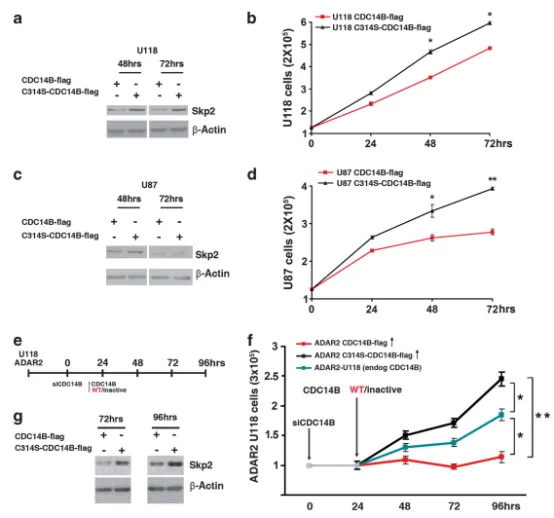
图6 ADAR2介导的CDC14B表达对星形细胞瘤细胞增殖的重要性
(a) U118细胞转染CDC14B-flag或失活突变体C314S-CDC14B-flag后48、72小时的Skp2蛋白Western blot;(b) 对应增殖曲线(Mean ± s.d., n=2),P < 0.05;(c)(d) U87细胞重复(a)(b)实验(Mean ± s.d., n=2),P < 0.05,P < 0.01;(e) "沉默-再表达"策略示意图:ADAR2-U118细胞先稳定沉默内源CDC14B(0小时),24小时后(内源降低约90%)等量转染CDC14B-flag(红)或C314S-CDC14B-flag(黑);(f) 增殖曲线:沉默内源CDC14B的ADAR2-U118(灰)及再转染CDC14B-flag(红)或C314S-CDC14B-flag(黑)组,以未处理ADAR2-U118(蓝)为对照(Mean ± s.d., n=2),P < 0.01(72、96小时C314S vs CDC14B-flag),*P < 0.05(ADAR2-U118 vs 两组突变/再表达);(g) 上述再表达实验中72、96小时的Skp2蛋白Western blot。
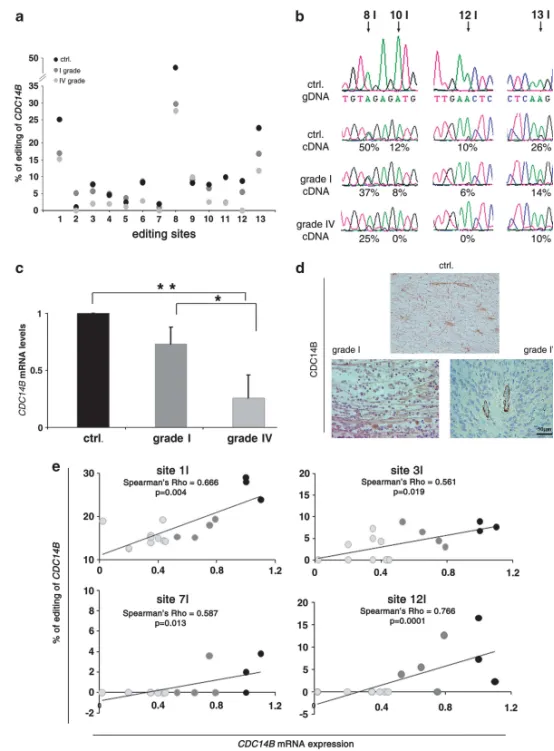
图7 CDC14B转录本在星形细胞瘤与正常脑组织中的编辑率与表达水平
(a) CDC14B内含子7-8 Alu区域13个编辑位点(1-13I)的编辑百分比:正常脑组织(黑,n=3)、I级(深灰,n=7)与IV级星形细胞瘤(浅灰,n=12);(b) 代表性测序色谱:白质对照(Ctrl)gDNA(上)及cDNA、I级与IV级肿瘤cDNA;箭头示编辑位点及百分比;(c) CDC14B mRNA qRT-PCR:正常脑、I级与IV级肿瘤(Mean ± s.d., n=3),P < 0.05,*P < 0.01;(d) CDC14B免疫组化:IV级、I级肿瘤与正常脑(Ctrl);内皮细胞为内参阳性对照(右下);(e) 各组织CDC14B编辑水平与mRNA表达相关性:正常(黑点)、I级(深灰点)、IV级(浅灰点)标本;示显著相关示例,采用Spearman非参数检验,P < 0.05为差异有统计学意义。
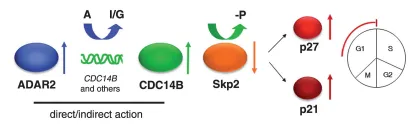
图8 ADAR2在星形细胞瘤细胞增殖中的作用模式图
ADAR2通过(直接和/或间接)促进CDC14B RNA编辑及过表达,驱动CDC14B蛋白升高;CDC14B诱导Skp2降解,进而上调p21与p27,使细胞周期阻滞于G1期,从而抑制增殖。
03 关于作者
小儿神经外科专注于解决儿童诸多神经外科疾病,包括脑肿瘤、脑积水、小儿癫痫、先天畸形等,一直被视为难度最大的外科专业之一。Concezio Di Rocco教授曾接受法国、埃及、吉尔吉斯斯坦等国家的邀请进行讲座和现场演示,并联合全球知名小儿神经外科专家创办儿童神经外科研究所课程。该课程在过去30年间为世界培养了大量儿童神经外科医生,目前国内多家知名三甲医院的儿童神经外科主任专家均曾师从于他。Di Rocco教授将领先治疗技术分享给世界各地儿科神经外科医生参考学习,为世界儿科神经外科发展做出重大贡献。教授曾到访苏州大学附属儿童医院,为6名神经外科疑难杂症孤儿提供义诊。


Di Rocco教授学术任职与成就:
国际儿童神经外科学会(ISPN)主席(1991-1994年)
世界神经外科联合会(WFNS)教育委员会共同主席(2013-2017年)
世界神经外科联合会儿童神经外科委员会主席(2001-2009年)
世界小儿神经系统知名杂志《Child's Nervous System》现任主编
国际儿童颅底学会主席(创始成员)
世界神经外科联合会基金小儿脑积水项目负责人
德国汉诺威国际神经科学研究所(INI)儿科神经外科主任(2013年至今)
欧洲神经外科学会(EANS)前副主席
世界神经外科学会联合会(WFNS)儿科委员会前主席
罗马天主教大学医学院儿科神经外科学系主任

自2014年5月起,Di Rocco教授担任德国汉诺威国际神经科学研究所(INI)儿科神经外科主任。从事儿童神经外科事业50余年,教授尤其擅长小儿神经纤维瘤、癫痫、脑积水、蛛网膜囊肿、颅缝早闭、脑和脊髓肿瘤、脑和脊柱畸形(半椎体畸形、皮质发育不良、脊髓脊膜膨出、脊髓内脂肪瘤、Arnold-Chiari畸形等)难治性疾病的诊疗,已完成超过12000例神经外科手术。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号