James T. Rutka(鲁特卡)教授作为世界神经外科学院前院长,现任神经外科专业期刊《Journal of Neurosurgery》主编,三十余年来持续深耕儿童神经外科研究领域。他带领科研团队在脑肿瘤分子分型、精准治疗、新药研发及微创治疗等方面取得系列突破,为全球罹患疑难疾病的儿童患者带来新的治疗希望。其近期发表的研究论文《儿童脑肿瘤免疫治疗的临床前模型:挑战与突破方向》主要内容如下。
研究内容概述
脑肿瘤是儿童群体中最常见的实体肿瘤类型,同时也是癌症相关死亡的主要原因。近年来,儿童中枢神经系统肿瘤的诊断和治疗水平取得一定进展。然而值得关注的是,许多高级别肿瘤患者的总体预后情况仍不理想。生存率较低的部分原因在于有效治疗手段的缺乏。免疫检查点抑制剂(ICIs)在成人肿瘤治疗中的成功应用,促使研究人员探索这些疗法单独或联合其他药物治疗儿科患者的潜力。但为改善临床结局,建立和选择合适的临床前儿科高级别脑肿瘤模型显得尤为关键。本研究回顾了开展国际合作研究时影响模型选择的关键因素,该研究主要测试ICIs联合表观遗传修饰剂在增强儿童脑肿瘤适应性免疫治疗中的作用,同时分享了研究过程中遇到的挑战及潜在解决方案。
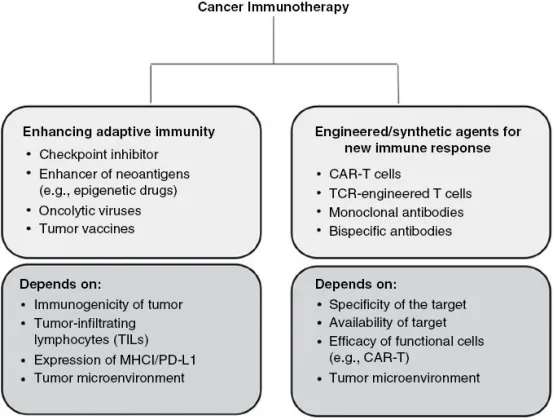
癌症免疫治疗的作用机制与影响因素
根据作用机制的不同,癌症免疫治疗可分为两种主要类型,并附有各类别代表性药物示例。对这些不同治疗方案的应答效果取决于多重因素,包括肿瘤内在和外在的生物学决定因素。
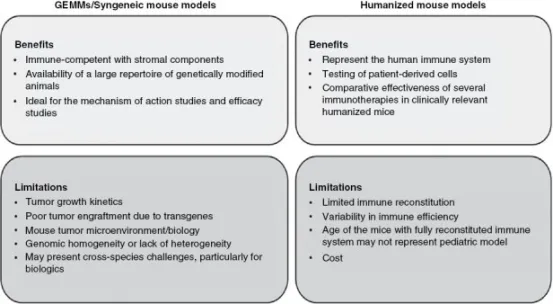
儿童脑肿瘤免疫治疗临床前小鼠模型的优势与局限
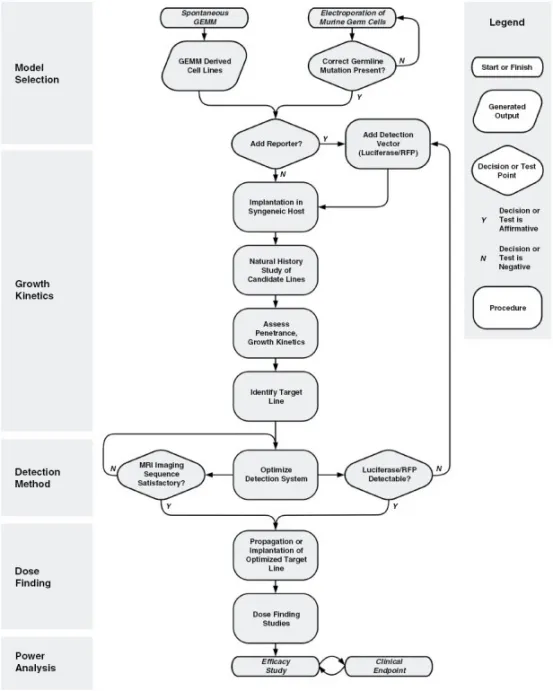
临床前模型选择流程包括源自自发肿瘤或特定基因构建的生殖系GEMM系等。在进行后续研究前需要确认突变状态的存在。根据肿瘤细胞的生成方式,需考虑在同系宿主进行自然史研究前是否引入报告基因(如荧光素酶/RFP)。评估多代小鼠的肿瘤外显率和生长动力学对建立可预测模型至关重要。若使用报告基因,需验证肿瘤检测能力;若采用MRI进行肿瘤监测,则需优化成像序列。剂量探索研究需考虑检测时间点以及可能影响结果的联合治疗方案。在开展疗效研究前,需进行效能分析以获得具有统计学意义的可靠数据,同时最大限度减少资源浪费。
研究结论与展望
儿童脑肿瘤免疫治疗领域的推进需要建立在对免疫系统、肿瘤生物学和肿瘤微环境(TME)的深入理解基础上。目前已经建立并正在使用临床前儿童脑肿瘤模型,旨在将动物模型中有效的治疗策略转化为人类临床试验。这些模型各具特点,认识到每种模型在临床研发路径中的定位至关重要。在前期投入资源严格开发临床前模型,有助于产生对临床研发决策具有指导意义的数据。
作者简介

James T. Rutka鲁特卡教授作为世界神经外科领域的权威专家,其研究成果对儿童脑肿瘤治疗策略的发展具有重要推动作用。他长期致力于推动神经外科技术的创新与临床应用,特别是在免疫治疗及靶向治疗等前沿领域作出了重要贡献。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号