INC国际神经外科医生集团旗下组织世界神经外科顾问团(WANG)成员、美国神经外科学院前主席、旧金山加利福尼亚大学(UCSF)神经外科系教授兼主席(1997年至今)Mitchel S. Berger教授等发表研究论文《Longitudinal profiling of IDH-mutant astrocytomas reveals acquired RAS-MAPK pathway mutations associated with inferior survival》(IDH突变型星形细胞瘤纵向分析揭示获得性RAS-MAPK通路突变与较差生存期相关),以下为主要研究内容概述。


核心研究要点
IDH突变型星形细胞瘤进展过程中获得导致RAS-MAPK通路激活的遗传学改变
RAS-MAPK通路遗传学改变的获得与IDH突变型星形细胞瘤患者总生存期较差存在相关性

异柠檬酸脱氢酶(IDH)突变型星形细胞瘤属于青年人群中最常见的原发性脑实质内肿瘤类型。该类肿瘤通常以低级别肿瘤形式发生,但尽管采用现有治疗手段,仍经常进展并转化为更高级别。然而,IDH突变型星形细胞瘤发生高级别转化和疾病进展背后的遗传学改变仍未得到充分阐明。
"IDH突变型星形细胞瘤"是2021年世界卫生组织(WHO)中枢神经系统(CNS)肿瘤分类中新编码的肿瘤类型,其特征包括:IDH1 p.R132或IDH2 p.R172位点突变、TP53双等位基因失活、频发ATRX失活(伴随端粒替代延长ALT现象)、1号染色体短臂和19号染色体长臂完整共缺失,以及独特DNA甲基化谱。该类肿瘤好发于青年人群(30-50岁),也可见于青少年及老年人群。常见发生部位为大脑半球,亦可出现在小脑或脑干。多数病例为散发性,少数病例与Li-Fraumeni、Ollier、Lynch等特定肿瘤易感综合征相关,由TP53、IDH1及DNA错配修复基因(MSH2、MSH6、MLH1、PMS2)的胚系突变导致。
多数肿瘤以低级别(CNS WHO 2级)起病,生长缓慢。但由于其浸润性生长特性(常超出影像学可见范围),单纯手术切除无法根治。虽然最大范围安全切除可改善预后,但IDH突变型星形细胞瘤会复发并常转化为高级别(CNS WHO 3级或4级),表现为生长加速和播散,需要放疗或化疗(如替莫唑胺)等辅助治疗。尽管其预后远优于IDH野生型胶质母细胞瘤,IDH突变型星形细胞瘤仍是恶性肿瘤,现有疗法无法治愈。然而,新的治疗策略为患者带来希望。
其分子特征是IDH1 p.R132或IDH2 p.R172位点的错义突变,此为肿瘤发生的起始事件,可通过产生致癌代谢物2-羟基戊二酸诱导胶质瘤CpG岛甲基化表型。TP53抑癌基因失活是另一个早期事件,与IDH突变协同促进肿瘤发生。随着肿瘤进展,多数病例会出现ATRX染色质重塑基因失活突变或缺失,从而通过ALT机制规避细胞衰老。在低增殖活性的CNS WHO 2级肿瘤中,通常仅存在IDH1/2、TP53和ATRX突变,而无其他致癌改变。
随时间推移,肿瘤会获得额外遗传学异常驱动高级别转化和治疗抵抗。其中最常见的是9p21.3染色体上CDKN2A纯合性缺失(编码细胞周期调控蛋白p16INK4a),多项研究证实其富集于复发/高级别肿瘤中,并与不良预后相关。因此,2021年WHO分类将CDKN2A纯合缺失列为预后分级因素,伴有该改变的肿瘤无论组织学特征如何,均被划分为CNS WHO 4级。
除CDKN2A缺失外,其他与高级别转化和不良预后相关的遗传学异常包括:其他细胞周期调控基因异常(如CCND2扩增、RB1突变/缺失);受体酪氨酸激酶基因(PDGFRA、MET)的扩增成为潜在治疗靶点;预后差的MYCN扩增;与不良预后相关的PIK3CA/PIK3R1突变(激活PI3K-Akt-mTOR通路);染色体拷贝数变异负荷与不良预后相关;以及替莫唑胺化疗后出现的体细胞超突变与恶性转化、预后差和脑脊液播散风险增加相关。
为深入探究驱动肿瘤进展和治疗抵抗的分子机制,研究团队基于172例连续患者的205个IDH突变型星形细胞瘤样本(涵盖所有CNS WHO分级和疾病时间点),进行全面的组织病理学评估和靶向基因组测序。研究发现,RAS-MAPK信号通路是复发性IDH突变型星形细胞瘤中频繁发生致癌性改变的新靶点,与高级别转化和不良预后相关。推测这些突变驱动治疗抵抗,或可成为靶向治疗的新方向。
研究方法
研究对172例患者的205份IDH突变型星形细胞瘤样本进行基因组学分析,这些样本包括初治未治疗和治疗后复发的肿瘤标本。研究人员将分子发现与临床结局及病理特征相结合,以明确RAS-MAPK信号通路中新型遗传学改变的相关性。
研究结果
在13%的IDH突变型星形细胞瘤中鉴定出RAS-MAPK有丝分裂信号通路内可能的致癌性改变,涉及KRAS、NRAS、BRAF、NF1、SPRED1和LZTR1基因。这些改变包括致癌组分(如KRAS、BRAF)的局灶性扩增和已知的激活突变,以及负调控组分(如NF1、SPRED1)的缺失和截短突变。这些RAS-MAPK通路改变在复发肿瘤中富集,且几乎均出现于高级别肿瘤中,并常与CDKN2A纯合性缺失共存。与携带RAS-MAPK野生型肿瘤的患者相比,其IDH突变型星形细胞瘤含有这些致癌性RAS-MAPK通路改变的患者总生存期更差。
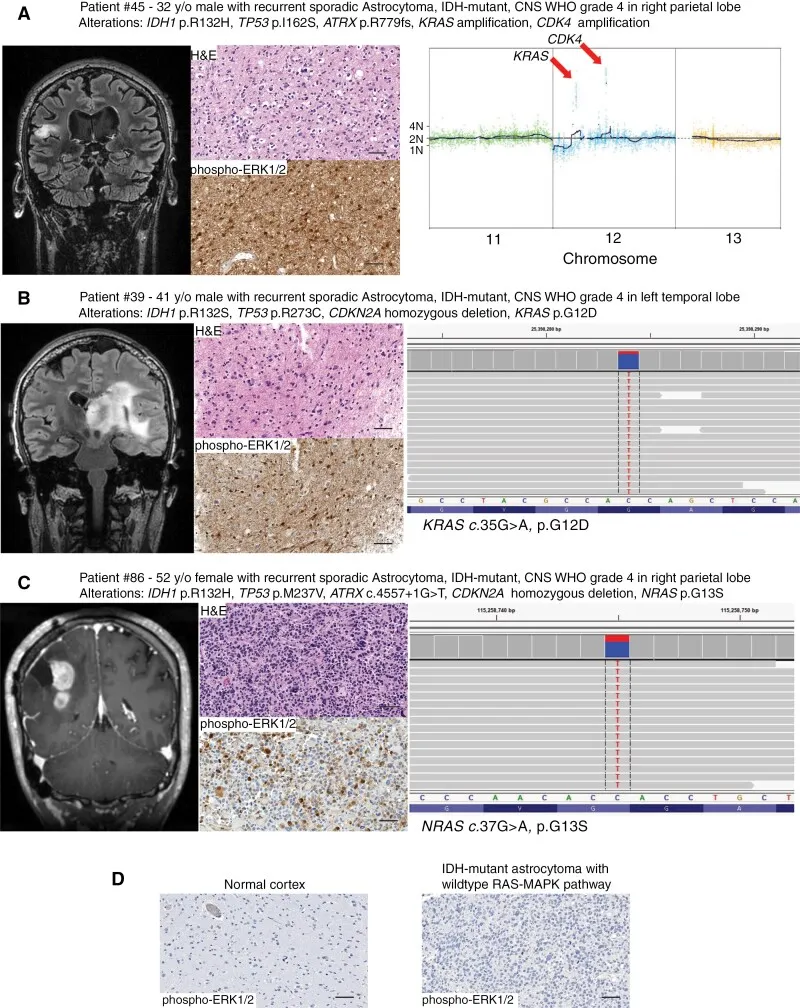
图示:复发性高级别散发性IDH突变型星形细胞瘤中存在多样化的RAS-MAPK通路致癌性改变。图示为3例代表性患者资料,包括冠状位对比增强T1加权磁共振图像、苏木精-伊红染色组织学图像、磷酸化ERK1/2(Thr202/Tyr204)免疫组化染色结果以及致癌性RAS-MAPK改变的示意图。
(A)12号染色体短臂12.1区(12p12.1)KRAS致癌基因的局灶性高水平扩增。
(B)KRAS p.G12D已知的激活热点错义突变。
(C)NRAS p.G13S已知的激活热点错义突变。
(D)正常大脑皮层与RAS-MAPK通路野生型IDH突变型星形细胞瘤的磷酸化ERK1/2(Thr202/Tyr204)免疫组化染色。
研究结论
总结而言,研究揭示RAS-MAPK通路改变在IDH突变型星形细胞瘤进展中的关键作用。研究发现这些RAS-MAPK通路突变在低级别IDH突变型星形细胞瘤的初次切除标本中通常不存在,而是在胶质瘤发生后期(主要见于高级别和复发肿瘤)获得性出现。它们常与CDKN2A纯合缺失、PIK3CA突变等已知预示不良预后的关键致癌事件共存。多因素分析进一步证实,这些RAS-MAPK通路致癌突变与复发性IDH突变型星形细胞瘤患者的不良生存期独立相关,因此应作为未来IDH突变型星形细胞瘤分子整合分级方案的潜在预后判定指标。
后续研究需重点探索针对伴有RAS-MAPK通路突变的IDH突变型星形细胞瘤的最佳治疗策略——考虑到该有丝分裂信号通路的激活可能驱动对常规放疗和替莫唑胺化疗的耐药性,同时可能增强对RAS或MEK抑制剂等特定靶向药物的敏感性。此外,新近FDA批准的IDH突变小分子抑制剂的疗效敏感性与耐药性的分子决定因素仍有待明确,特别是这些RAS-MAPK通路突变能否预测哪些患者可获得良好疗效、哪些需要联合多药治疗,将成为重要研究方向。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号