我父亲2003年查出胶质瘤,当年做了手术全切。2017年复发又做了手术,病理为少突胶质细胞瘤(who 2级)。2019年又复发,而且肿瘤从脑部转移到了脊髓多处,手术后病理为胶质肉瘤(who 4级)。少突胶质细胞瘤应该是预后很好的一种胶质瘤,我不太理解为什么一年多就发展为了4级?
答:胶质瘤是一种由异常生长的胶质细胞所形成的原发性中枢神经系统的肿瘤。基于胶质瘤的组织学特点,胶质瘤病理分级可以分为1-Ⅳ级。1/Ⅱ被归为低级别胶质瘤,Ⅲ/Ⅳ被归为高级别胶质瘤。低级别胶质瘤一般生长较为缓慢,大约占全部颅内原发肿瘤的10-20%。胶质母细胞瘤预后较差,中位生存期0-14个月,有不到5%的患者在确诊后可以生存5年以上。相比于高级别胶质瘤,低级别胶质瘤预后较好。尽管LGG的自然病程差异很大,但不少患者的病情会恶化。许多患者会出现一段放射影像学和临床上相对稳定的时期,此期在星形细胞肿瘤患者中平均为5-7年,而少突胶质细胞肿瘤患者常持续更久。然而,肿瘤生长较终会加快,之后的临床病程会难以与高级别胶质瘤相区分。
美国监测、流行病学与较终结果(Surveillance,Epidemiology and Results,SEER)数据库的结果阐明了低级别星形细胞肿瘤和少突胶质细胞肿瘤的预后和自然病程。在该分析中,预后与诊断时的年龄相关。在1990-2001年间诊断出肿瘤的患者中,20岁以下、20-64岁及64岁以上患者的10年生存率分别为86%、53%和20%。自1990年以来,成人的生存率已有所提高,这很可能反映的是:采用更好的影像学手段更早地诊断出了有轻微症状的患者;以及治疗取得了进步。
分子标志物能为LGG患者的预后提供可靠信息。是IDH基因(IDH1和IDH2),携带该基因突变的患者预后远远好于缺乏这些分子标志物的患者。其他有利的预后标志物包括1p/19q联合缺失,以及MGMT基因启动子甲基化。
已有多项研究检验了诊断时有助于评估预后的临床和组织学因素。较常发现能评估总体生存情况较差的临床特征包括:
病人的预后和诊断时的年龄相关。分子学特点是那些含有IDH1和IDH2突变的病人,相比于那些缺乏这种分子学特征的患者,预后会更好。较常见的揭示不良预后的临床特点包括:较大的年龄(例如≥40岁)、功能状态差、非癫痫发作的临床表现(局灶性神经缺损,颅内压增高)、位于额叶和顶叶以外、肿瘤较大(≥5 cm)或MRI显示位于肿瘤内部明显的强化、不全切除、星形细胞成分、高的增殖指数(MIB-1>3%)。尽管如此,仍有50-75%的低级别胶质瘤患者死于肿瘤进展或者变为更高恶性等级的肿瘤。而这种低级别胶质瘤进展并发展为恶性度更高的肿瘤的趋势迫使我们去进一步了解关于肿瘤复发和恶变的潜在因素。
儿童LGG的自然病程似乎比成人更长。一项病例系列研究纳入了65例Ⅱ级星形细胞瘤患儿(诊断时平均年龄为13岁),发现15年时的累积恶性转化率为7%。
恶性转化(malignant transformation,MT)是指低级别肿瘤进展为WHO III或IV级肿瘤。根据现有文献,LGG MT的发生率为23-72%,恶性转化的中位时间为2.7-5.4年。这些研究的诊断方法并不一致。在这些发表的系列中,恶性转化是通过活检、CT影像改变和MRI影像改变确定的。恶性转化对生存率有负面影响,在相关研究中有50%的患者死于MT,而MT致死的中位时间仅为一年。预后因素可能包括星形细胞瘤组织学、未全切、肿瘤大于3cm。然而,MT的危险因素和预后目前仍不完全明确。
低级别胶质瘤恶性转化相关研究1:
美国俄亥俄州克利夫兰诊所放射肿瘤学科的Erin S.Murphy等对胶质瘤恶性转化的危险因素进行研究,结果发表于2018年3月的《Int J Radiat Oncol Biol Phys》。

该研究共纳入599例低级别胶质瘤(WHO 2级)患者,平均随访88.3个月。根据是否发生MT,124例分入MT组,475例分入非MT组。对比两组患者的一般资料、肿瘤特征、手术切除程度、治疗方案、MT情况和预后。以多因素回归分析明确MT的危险因素。
数据分析后发现,599例低级别胶质瘤患者的MT发生率为21%,发生于随访至平均56.4个月时。MT组124例中,76例经活检证实恶性转化。MT组5年和10年无进展生存率分别为30.6%±4.2%和4.8%±1.9%,5年和10年总体生存率分别为75%±4.0%和46%±5.0%;非MT组5年和10年无进展生存率分别为60%±2.4%和38%±2.7%,5年和10年总体生存率分别为87%±1.7%和78%±2.3%。多因素分析结果表明,高龄(P=0.001)、男性(P=0.004)、多发肿瘤(P=0.004)、单纯化疗(P=0.012)以及手术未完全切除(P=0.045)是肿瘤发生恶性转化的危险因素(表1)。1p19q分子检测结果与MT无明显相关(HR=1.22;95%CI,0.79-1.89;P=0.36)。
表1.胶质瘤MT危险因素的多因素分析。
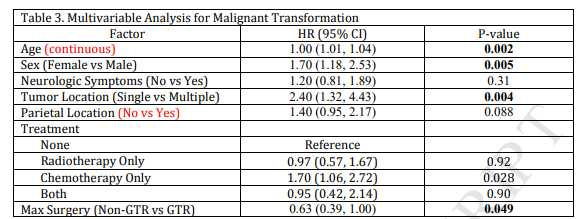
缩写:HR=危险比;GTR=全切除
该研究结果显示,低级别胶质瘤恶性转化发生率为21%;MT影响胶质瘤患者的生存期,其危险因素包括高龄、男性、多发肿瘤、单纯化疗以及手术未完全切除肿瘤。但此结论有待开展前瞻性研究验证。
低级别胶质瘤恶性转化相关研究2:
另一项相关研究中,回顾性分析1996年至2006年间在约翰·霍普金斯接受开颅手术和切除半球低级别胶质瘤(世卫组织二级)的成年患者。多变量比例风险回归分析被用于确定与肿瘤复发和恶性变性的关联。

在该系列中连续191例低级别胶质瘤患者(89例原纤维型星形细胞瘤、89例少突胶质细胞瘤和13例混合型胶质瘤)中,分别有83例(43%)和44例(23%)在较后一次随访时出现肿瘤复发和恶性变性。5年无进展生存率和无恶性肿瘤生存率分别为44%和74%。复发的独自评估因子是持续时间较长的症状(相对风险[RR]0.978,95%CI 0.954-0.996,p=0.01)、肿瘤大小(RR 1.328,95%CI 1.109-1.602,p=0.002)和术前对比增强(RR 2.558,95%CI 1.241-5.021,p=0.01)。与恶性变性相关的独自因素有纤维型星形细胞瘤(FA)病理(RR 1.800,95%CI 1.008-4.928,p=0.04)、肿瘤大小(RR 1.086,95%CI 1.044-1.358,p=0.04)和是否全切(RR 0.526,95%CI 0.221-1.007,p=0.05)。
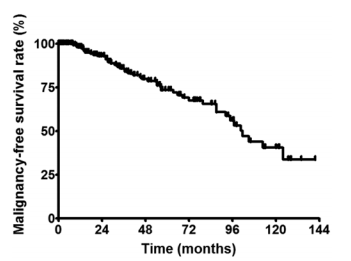
图示:成人大脑半球低级别胶质瘤切除后恶性变性的Kaplan-Meier图。5年和8年无恶性肿瘤生存率分别为74%和56%。
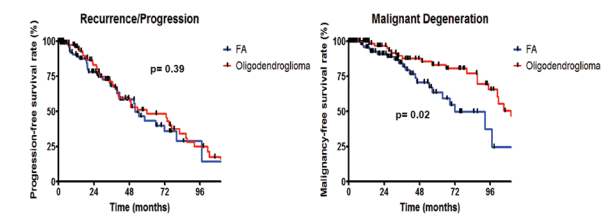
图示:Kaplan-Meier图。左图:FA或少突胶质细胞瘤患者的5年和8年无进展生存率分别为44%和48%,以及29%和25%(p=0.39)。右图:FA或少突胶质细胞瘤患者的5年和8年无恶性肿瘤生存率分别为64%和83%,以及37%和66%(p=0.02)。
该项研究中,与恶性变性相关的因素关于肿瘤组织学预后影响的研究主要集中在生存率上,在一些研究中,FA病理学与生存率降低相关。肿瘤组织学和复发或恶性退行性变仍相对缺乏研究。之前的两项研究发现肿瘤组织学与复发或恶性变性之间没有关联。然而,这些研究受到患者人数少、包括接受活检程序的患者以及在多变量分析中无法控制已知影响结果的变量的限制。本研究中的肿瘤组织学与肿瘤复发无关,但是恶性变性的独自评估因子。有趣的是,FAs和少突胶质细胞瘤患者的复发率和/或进展率相似。然而,与少突胶质细胞瘤患者相比,FAs患者更容易发展为高级别肿瘤。因此,这表明,尽管两种类型的低级别胶质瘤的复发率相似,但FAs更可能发生恶性变性并伴有肿瘤复发。这可能是因为FAs主要由异常的星形胶质细胞组成,它们更容易发生恶性变性。
与复发一样,在本研究中,肿瘤大小也与恶性变性独自相关。这些发现支持先前的研究,即肿瘤大小与生存有关。事实上,肿瘤大小每增加一厘米,恶性肿瘤的风险就增加1.1倍,而肿瘤≥3厘米的统计意义较大,恶性肿瘤的风险增加2.6倍。更大的低级别肿瘤,类似于恶性肿瘤,可能有增加的增殖能力,这可能增加恶性变性的机会。这进一步支持了在肿瘤体小时进行早期手术干预的潜在必要性。
较后,本研究中的GTR独自降低恶性变性风险1.9倍。此外,在多变量分析中,GTR倾向于对肿瘤复发具有重要意义。这些发现支持了先前的研究,这些研究表明切除范围和生存率之间存在关联,并将这些发现扩展到降低恶性肿瘤风险和可能延迟复发。这表明,当这些肿瘤可进行根治性切除时,应进行GTR。
上述研究得出结论:与高级别病变患者相比,低级别胶质瘤患者通常具有更有利的预后。尽管如此,大多数低级别胶质瘤患者较终会死于肿瘤进展为更恶性的形式。
低级别胶质瘤复发了怎么办?
采用MRI来区别复发和放射性坏死困难,很多时候还需要活检。复发时,可以考虑挽救性的手术,放疗和化疗等的联合治疗。复发之后的病变,既可能是低级别胶质瘤还有可能是高级别胶质瘤。
放疗
在一次放疗(45和60 Gy)之后,再次的传统外照射治疗通常不可取。一组172例复发的胶质瘤患者中,包括71例2级和101例3级或4级的胶质瘤病人,以前均接受过特定剂量的放疗。复发之后,全部病人再次接受了总剂量36 Gy的18次照射,采用立体定向放疗来提高局部剂量,LGG病人的平均生存期是22个月。
化疗
两组研究报道认为,两类肿瘤(同时包含星形细胞瘤和少枝胶质细胞肿瘤)使用替莫唑胺后的客观反应率是类似的,但是那些不含有1p19q双缺失的病人反应时间较短。一旦肿瘤显示出恶性去分化,则反应率和反应持续时间均类似于复发的间变星形细胞瘤,大约2/3的病人存活并保持了6个月的无进展期。
低级别胶质瘤治疗关键点:年轻病人(≤45岁),肿瘤全切之后,并且包含有利的分子学特点的,例如IDH突变和1p19联合缺失者,我们建议手术之后观察随访。此类病人较终会复发,在肿瘤进展之后仍然需要辅助治疗。含有IDH野生型的肿瘤以及含有较差预后因素的,例如肿瘤残留,年龄>45岁,神经缺损症状,大的有占位效应的肿瘤,建议术后立即给予辅助治疗。对于不属于上述两类情况的病人,则危险因素越多,越倾向于术后立即辅助治疗。对于高危险的LGG,建议放疗联合化疗,而不是单独使用。化疗选用PCV方案,而不是替莫唑胺。
当然,很多患者又会疑惑,既然低级别胶质瘤即使治疗也会复发、恶化,不如保守治疗算了。但是患者应该对低级别胶质瘤的治疗有正确的认识:它不是“不治之症”,患者治与不治生存期差别较大;手术切除方面也存在很多策略,并不是很多人认为的“切多切少一个样”。此外,低级别胶质瘤的治疗不单是外科手术切除,还要靠术后放化疗等综合辅助手段予以配合。治疗的目标主要包括延长总生存期和无进展生存期,并尽量减少与肿瘤及其治疗相关的并发症,其中更好的生活质量也是现在患者追求的重要目标。即使复发,不少患者也能够从二次手术中获益。
交流一则2020年的脑干肿瘤手术经典专著《Surgery of the Brainstem》中13章Adult Brainstem Gliomas(成人脑干胶质瘤)中的经典案例。
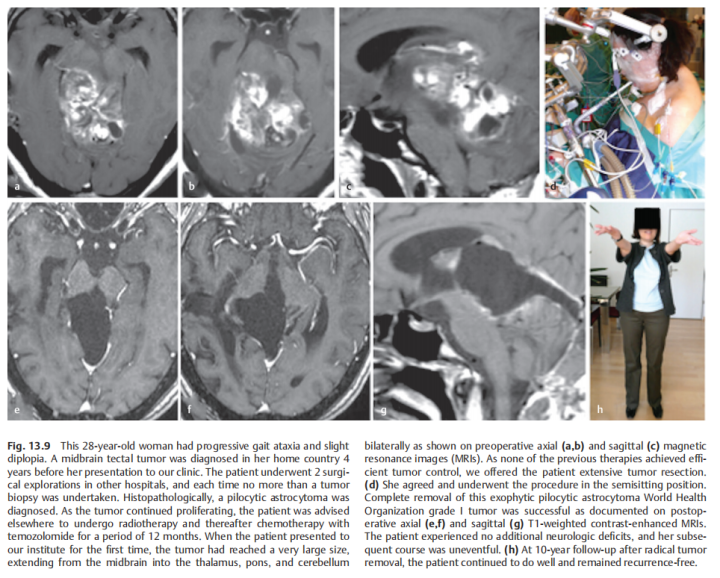
术前:28岁女性,有进行性步态共济失调和轻微复视。在德国INI就诊的四年前,在本国医院被诊断出中脑顶盖肿瘤,接受了两次外科手术,活检诊断为毛细胞星形细胞瘤。随着肿瘤继续长大,建议患者在其他地方接受放疗,然后用替莫唑胺进行化疗,为期12个月,然而治疗均未达到合适的肿瘤控制。随后联系德国巴特朗菲教授进行咨询,得到了教授可以为其治疗的全切手术方案,遂咨询到德国治疗。
术后:术后1天,ICU治疗观察。术后2天:复查CT正常,拔除气管插管,有轻微头痛,可完全自主呼吸。术后4天:患者无明显呼吸机活动障碍,复视有所好转,无肢体瘫痪、面瘫等,转至普通病房继续治疗。患者能在协助时下床、简单日常活动,在康复师指导下进行康复锻炼,头痛明显好转,步态不稳好转,肢体无力稍好转,无呼吸控制、肢体瘫痪加重等手术相关并发症。术后10天:顺利拆线,术后3周出院,无头痛、肢体无力等,复视、步态不稳较术前明显好转。
术后影像复查:轴位(e,f)和矢状位(g)T1加权增强MRI检查显示,外生型毛细胞星形细胞瘤被成功切除。病人没有出现手术相关的神经功能损伤,随后的随访病程平安无事。
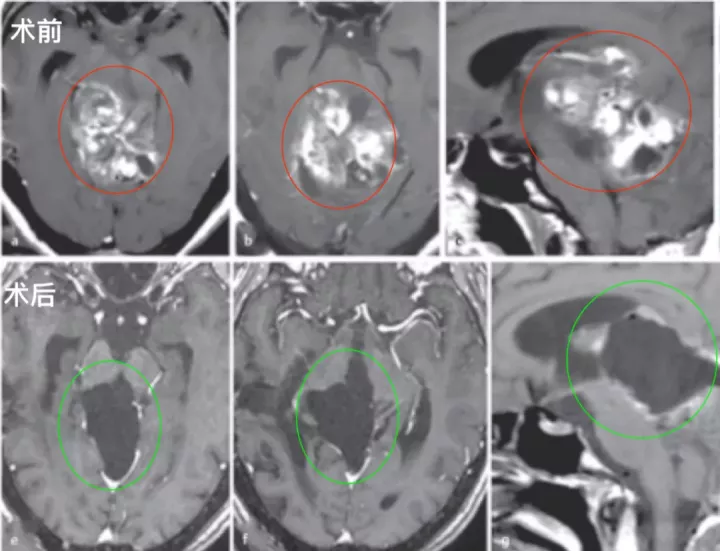
图:术前术后脑磁共振对比,较大脑干胶质瘤全切,无神经脑组织损伤。

图:显示在根治性肿瘤全切除术后10年的随访中,患者的病情持续良好,无肿瘤复发。
参考资料:
1.HelmutBertalanffy.Chapter 13 Adult Brainstem Gliomas.Surgery of theBrainstem.Thime.2020.
2.doi:10.1016/j.ijrobp.2017.12.258
3.doi:10.3171/2008.10.JNS08608
4.魏社鹏,赵继宗.低级别胶质瘤的治疗.国际神经病学神经外科学杂志

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号