儿童中,起源于脑干(中脑、脑桥和延髓)的胶质瘤占全部中枢神经系统(central nervous system,CNS)肿瘤的10%-20%。脑干胶质瘤具有异质性,从几乎无需治疗的低级别肿瘤到尽管治疗仍迅速致命的高级别肿瘤都有发生。预后和治疗方案取决于肿瘤的组织学特征和在脑干内的位置。
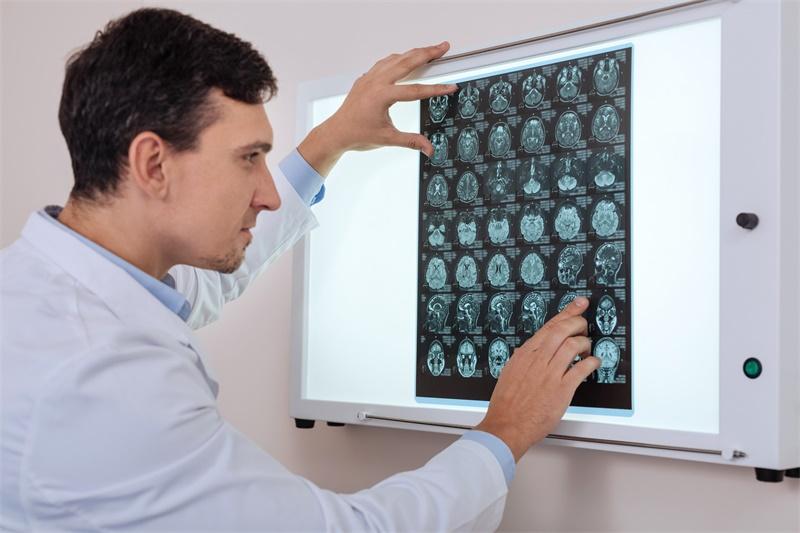
局灶性脑干胶质瘤通常起自中脑和延髓,通常为边界清楚的离散性肿瘤。组织学上,这些肿瘤较常为毛细胞型或弥漫性星形细胞瘤,偶尔为节细胞胶质瘤,全部都是低级别肿瘤。局灶性脑干胶质瘤与颅后窝和幕上低级别胶质瘤有很多相同的生物学特征,分析参与其发病机制的信号通路取得了很大进展。
脑干胶质瘤的治疗
脑干胶质瘤的治疗需考虑肿瘤的解剖位置,后者决定了患者的症状及手术切除入路是否可及。脑干低级别胶质瘤患者的远期预后较好。
较好是由一个团队进行治疗,包括经验丰富的神经外科医生、放射肿瘤科医生、神经肿瘤科医生,以及社会心理工作者、教育专家、理疗师和作业治疗师。拥有神经肿瘤专科团队的化三级医疗中心是实施上述多学科治疗的较佳选择。
治疗方案
在局灶性脑干胶质瘤的治疗中,手术切除、放疗(radiation therapy,RT)和化疗都有各自的作用。
手术治疗
脑干胶质瘤位于CNS较重要的功能区之一,过去认为无法实施手术,故大多数患者接受放疗。
然而,随着术中影像学技术和引导技术的进步,外科医生较大水平切除肿瘤并保存正常组织和功能的能力已提高。尽管目前尚无随机试验,但是对于手术路径可抵达的局灶性脑干胶质瘤,如某些病例的延髓-颈髓交界处肿瘤以及背侧外生性肿瘤,优选手术切除。PET可精确定位脑干肿瘤内较高级别区域,可帮助指导活检部位。对于禁忌切除的儿童和成人患者,立体定向活检能提供重要的组织学和分子信息,以指导进一步治疗。
已行切除的肿瘤中大约有30%会出现进展并需要进一步治疗。如果手术路径可抵达病变,可考虑再次手术。对于其他患者,较合理的方案分别是对儿童进行化疗和对成人进行局部放疗。
放疗
对于手术路径不能抵达的脑干局灶性肿瘤,放疗是重要替代手段。采用标准分割的外照射治疗可控制约50%-70%的局灶性病变。这种疗法的总放射剂量为54Gy,分为一日1次、一周5日,共6周,对有限的病灶体积照射,照射边缘控制在0.5-1cm。
脑干胶质瘤中放疗应用的进展主要集中在通过限制对正常组织的辐射剂量降低并发症发生率。新型适形放疗技术包括立体定向放射外科(stereotactic radiosurgery,SRS)、分次立体定向放疗(fractionated stereotactic radiotherapy,SRT)、调强放疗(intensity-modulated radiation therapy,IMRT)、容积旋转调强放疗(volumetric modulated arc radiotherapy,VMAT)和质子放疗,这些技术可尽量减少对一般正常脑组织的照射,这对脑干肿瘤放疗重要,因为脑干肿瘤常常靠近垂体和视神经等重要结构。
尽管还未在局灶性低级别脑干胶质瘤患者中比较这些技术与常规外照射,但在更常见肿瘤(如低级别视路胶质瘤或髓母细胞瘤)中开展的试验已经影响了临床实践。脑干肿瘤具体治疗技术的选择因人而异,既要考虑技术条件,又要充分覆盖肿瘤而不影响重要器官和正常组织。
尽管放疗可实现长期无进展生存,但可伴严重并发症,特别是对较年幼的儿童。长期影响包括垂体和下丘脑受到放射后引起生长减缓和其他内分泌疾病,认知和听力障碍,可导致脑卒中的血管狭窄,以及治疗引起的继发性恶性肿瘤的风险。因此,放疗应尽量仅限于成人和年龄较大的儿童,以尽可能降低远期并发症发生率。头颅照射的迟发性并发症详见其他专题。
化疗
化疗在避免或推迟脑干胶质瘤患儿接受放疗中的作用越来越重要。
只有少数临床研究评估了化疗治疗脑干局灶性低级别胶质瘤的疗效。与放疗一样,化疗的临床实践受到治疗小脑幕上和四脑室低级别胶质瘤经验的影响。
化疗可使肿瘤生长保持稳定,还能避免或推迟年幼儿童的放疗需求,对生存质量产生影响。获得上述作用的同时不会降低确定性治疗的疗效,因为并未发现在化疗时或化疗后进展的肿瘤对放疗的反应降低。
每周接受长春新碱和卡铂治疗的低级别胶质瘤儿童中,约40%得到客观缓解,疾病在一段时间内保持稳定的比例可能更高。例如,一篇报道发现,2年和3年无进展生存率分别为75%和68%。已观察到其他化疗方案[如6-硫鸟嘌呤、丙卡巴肼、洛莫司汀和长春新碱(TPCV)]有相似的结果。
儿童低级别胶质瘤的较佳化疗方案尚不明确,大多数试验纳入了肿瘤遍布于脑和脊柱的患者,并不仅仅是肿瘤局限于脑干的患者。美国一项纳入CNS低级别胶质瘤儿童的全国性试验比较了每周卡铂/长春新碱方案与TPCV,两者疗效基本相当。每月使用卡铂单药治疗(不用长春新碱)似乎疗效相似。由于毒性低于TPCV,大多数医疗中心会考虑将含卡铂化疗用作优选一线治疗。
一些初步研究数据提示,在接受其他化疗或放疗后病情进展的患者中,使用长春碱、贝伐珠单抗、节拍式治疗、来那度胺和替莫唑胺可能合适。全部这些研究均是在异质性低级别胶质瘤的小型患者组中进行的,因此还需要进行更具确定性的临床试验来评估其完全活性和长期毒性。
靶向于儿童低级别胶质瘤中特定通路的药物也已进入临床试验。尽管特定人群中的早期数据令人鼓舞,但一些治疗刺激了肿瘤生长,而不是控制肿瘤生长,这凸显了儿童低级别胶质瘤的复杂信号通路。因此,这些靶向控制剂应仅用于前瞻性临床试验。
儿童低级别胶质瘤的囊性扩张可导致严重的并发症。对于肿瘤实性成分稳定但囊性部分不断扩大的患者,几乎没有证据显示全身性化疗或放疗是控制进一步囊性扩张的较佳方法。目前已研发出多种通过贮液囊来治疗囊性肿瘤的方法,包括放射性磷(P32)、博来霉素和干扰素α。
顶盖肿瘤
起源于中脑背侧的较小顶盖胶质瘤,通常引起导水管梗阻,并伴有颅内压增高的症状。顶盖肿瘤的初始治疗是通过脑室腹腔(ventriculoperitoneal,VP)引流分流脑脊液(cerebrospinal fluid,CSF),更可取的是采用三脑室造口术。后一种操作避免了颅内植入异物,并且可作为日间手术施行。
顶盖胶质瘤的自然病程一般较长,即使采用现代神经外科方法也可能出现严重并发症[100]。除非出现不典型的特征,一般无需活检,许多低级别顶盖胶质瘤较初可观察处理,无需除分流外的其他任何干预。已病理取样的顶盖胶质瘤中,组织病理学特征大多类似于毛细胞型星形细胞瘤。一项包含分子分析的研究分别在25%和8%的顶盖胶质瘤中检出了BRAF融合或BRAF V600E突变,没有肿瘤携带组蛋白H3 K27M突变。
仅接受分流术的患者中有较高比例可保持无进展而无需进一步治疗。一项单机构研究纳入了25年间的46例顶盖胶质瘤患儿,86%的患儿需要脑脊液改道,23%接受了放疗,18%需要全身性治疗。10年无进展生存率和总生存率分别为49%和84%。
顶盖胶质瘤进展的危险因素包括就诊时病灶大小超过10立方cm、对比增强和囊性改变。
解除颅内压增高后,持续存在症状或进行性增大的肿瘤应接受手术治疗(可能性较小)、化疗或局部放疗(若不能化疗)。较年幼儿童的肿瘤进展可尝试化疗,目标为使肿瘤生长保持稳定。
背侧外生性胶质瘤
背侧外生性胶质瘤的治疗依赖于手术切除(只要有可能进行)。顺利切除一般需要术中引导以实现较大水平的肿瘤切除。然而,由于此类病变大多起源于四脑室底,所以肿瘤与脑干之间可能没有确切的界面,即使是较佳切除也可能会在四脑室底残留一小片肿瘤。
尽管通常不能完全切除肿瘤,但大多数患儿的长期情况较好。在两项独自的病例系列研究中,分别有16例和10例患儿仅接受手术,中位随访期分别为113个月和26个月时,两项研究中分别有12例和7例患者无肿瘤进展。在这两项病例系列研究中,通过随后的再切除和/或放疗控制了复发性肿瘤。
不需要进行常规的术后放疗,应仅在少见的高级别胶质瘤患者或一次切除后进展迅速的低级别胶质瘤患者中考虑进行术后放疗。可通过再切除、放疗或化疗治疗晚期复发。
除了低级别星形细胞瘤外,在此区域还可观察到节细胞胶质瘤。这类肿瘤的诊断和治疗与低级别星形细胞瘤相似。此外,约60%的节细胞胶质瘤存在BRAF V600E突变[31]。目前正在开展关于靶向治疗的临床试验,但调节BRAF的信号通路很复杂,已观察到一些靶向治疗可刺激儿童低级别胶质瘤生长,而不是控制肿瘤生长,具体取决于基础分子异常。
延髓肿瘤
起源于延髓内部,或者位于面神经丘平面(位于四脑室底的脑桥部分)的肿瘤常不能行手术。对这些部位的病灶进行手术切除会造成难以接受的并发症发生率。因此,优选化疗或对成人行放疗。
延髓-颈髓肿瘤
这些肿瘤常被视为脊髓肿瘤,治疗也类似于脊髓肿瘤。
优选手术,约75%的病例可实现肉眼下全切。对于典型的低级别肿瘤,长期生存的概率很大,术后不需要化疗或放疗。如果术后肿瘤复发或进展,可采用化疗(针对儿童患者)或放疗(针对成人患者)进行治疗。由于该部位的许多节细胞胶质瘤都存在BRAF V600E突变,可通过切除术或活检获取重要遗传信息,必要时可指导靶向治疗。
囊性肿瘤
一些低级别胶质瘤有囊性成分。在这种情况下,这些肿瘤的生物学行为可能独自于其实性成分。囊液蓄积可导致神经系统功能障碍及症状,必需进行治疗。
这类囊性病灶的处理颇为棘手。基本治疗包括引流。囊液再蓄积的治疗方法包括反复引流、尝试移除囊壁、用于低级别胶质瘤的全身性化疗、局部放疗,偶尔还包括向囊腔内注入博来霉素或干扰素α。
预后
许多研究显示,脑干低级别胶质瘤患儿的长期生存率接近全切。另一方面,无进展生存率为40%-70%,长期失能较常见。发生这类失能的原因包括治疗相关的并发症和肿瘤相关的神经功能受损,后者源于脑干、长神经束和脑神经受压。已有研究发现,一些分子特征是重要的预后标志,例如周期素依赖性激酶控制剂2A(CDKN2A)缺失是一种高危特征。
神经功能和认知功能结局—儿童期CNS肿瘤幸存者通常存在程度的神经认知功能障碍。障碍程度主要取决于接受治疗时的年龄及放疗剂量。
对于局灶性脑干肿瘤的幸存者,就诊时症状的持续时间及肿瘤相关失能的严重程度,是评估患者远期神经功能结局较重要的参数。需要植入脑室腹腔(ventriculoperitoneal,VP)分流管的肿瘤患者还可出现长期置管相关远期并发症,包括感染风险和需要手术修正分流。
生存期是较重要的长期结局,但是因为大多数患者可以生存数十年,所以需考虑到其他因素。随着有多种其他治疗方案可供选择,手术应致力于确认肿瘤生物学特性;首要目标是将并发症发生率降到较低,而不是完全切除肿瘤。同样,放疗的迟发性并发症也支持使用效果稍差但远期并发症明显更少的方案,例如化疗。
治疗策略需个体化,考虑患者的身体、遗传和认知因素。例如对于某些患者,特别是1型神经纤维瘤病患者,如果肿瘤进展有限且无症状,可推迟治疗。对于大多数其他患者,切除不完全的肿瘤将复发,很可能就不应推迟治疗。
越来越多的证据提示,多学科评估对于CNS肿瘤幸存者重要。除了关注治疗相关的身体和医学问题(如癫痫发作的控制、身体和技能康复训练)外,还需关注患者的认知功能。即使是仅接受手术的低级别脑干胶质瘤患者也可出现严重功能受损,这表明应将全部患者视为存在风险。为了处理这类问题,需要心理学家、神经心理医生及学校联络专员介入。因为儿童期需要不断学习新能力,在某个时间点能达到与年龄相应的能力并不能确保在以后能继续达到相应的发育里程碑。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号