引言
少突胶质细胞肿瘤占全部胶质肿瘤的5%-10%,通常起病于30-60岁,少突胶质细胞瘤起源于少突胶质细胞,大多数少突胶质细抱瘤发生于成年人,肿瘤好发于大脑皮质和大脑半球,但也可发生在小脑、脑干、脊髓和原发性软脑膜。肿瘤生长缓慢,无包膜,但与正常脑组织界限清楚,以膨胀性生长为主,很多都有钙化表现,肿瘤生长缓慢,多数少突胶质细胞瘤预后优于星形细胞瘤。尽管少突胶质细胞肿瘤的临床病程较长,但几乎都会缩短患者的生命。
在过去,少突胶质细胞肿瘤的治疗决策主要基于肿瘤分级(Ⅱ级vsⅢ级)。根据2016年WHO中枢神经系统肿瘤分类修订版,现在确诊少突胶质细胞瘤需同时存在异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变和1p/19q共缺失。根据组织病理学特征将肿瘤分为Ⅱ级(低级别)或Ⅲ级(间变性)少突胶质细胞瘤。但是,在用分子学技术诊断胶质瘤的时代,经过放疗和化疗后,Ⅱ级和Ⅲ级少突胶质细胞瘤的生物学和预后差异变得微不足道。2021年更新WHO CNS 5,是继四版(修订)一次推出整合了组织学表型和基因表型的CNS肿瘤分类的二次更新。其中病理分类分级中不再有“间变性或间变型”类型。
少突胶质瘤中的关键基因分子标志物解读:
1.同时发现IDH突变和1p/19q共缺失才能确诊少突胶质瘤。
2.IDH——2级少突胶质瘤中的IDH1或IDH2通常表明生存期较长。
3.1p/19q共缺失——2级少突胶质瘤中的1p/19q共缺失较有可能对替莫唑胺化疗反应良好。
4.TERT启动子甲基化——发现该生物标志物与IDH突变和1p/19q共缺失同时出现时,有助于确认少突胶质瘤的诊断。
本文将重点总结Ⅱ级IDH突变伴1p/19q共缺失型少突胶质细胞瘤全切后的治疗策略。
手术切除对于疑似弥漫性胶质瘤患者,手术可为确诊提供组织,并可缓解占位效应引起的症状。与其他胶质瘤一样,较大限度切除是少突胶质细胞瘤的优选治疗方案,全切可好转结局。但根据肿瘤的位置和范围,只做部分切除甚至只活检也顺利可行。然而,很多时候,即便已经实施了手术治疗,仍然需要接受放化疗等综合治疗。
因此,对于Ⅱ级少突胶质细胞瘤完全切除的患者或者家属经常会有这样的疑惑:“手术做好了,治疗就成功了?还需要其他治疗吗?”手术不能治愈少突胶质细胞瘤患者,全部患者较终都需额外治疗(即放疗和化疗)。标准治疗方案也在与时俱进地变化,20世纪90年代启动的随机试验长期随访发现,在Ⅱ级少突胶质细胞瘤中,综合治疗均优于单纯放疗。
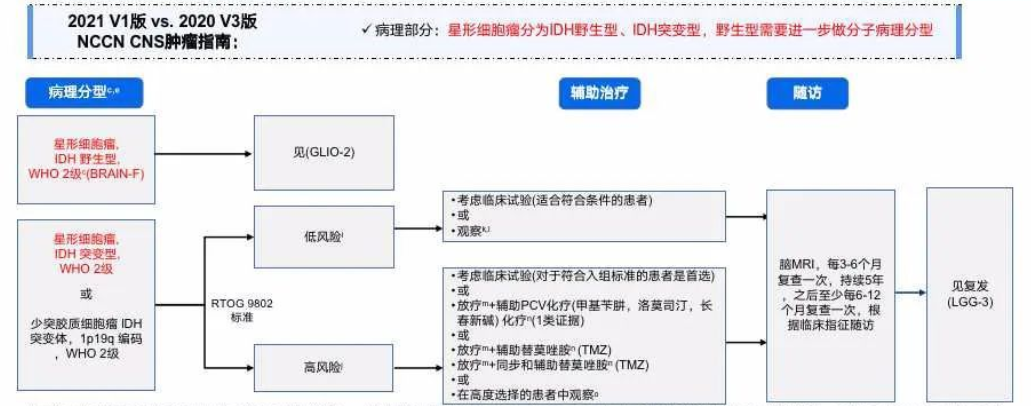
那么,Ⅱ级少突胶质细胞瘤术后下一步具体怎么治疗?治疗策略主要有这几个选择:放疗?化疗?放疗+化疗?还是放化疗同步?对于Ⅱ级少突胶质细胞瘤患者术后放射治疗的应用价值仍存在争议,目前仍未明确一些情况下额外治疗的较佳时机,对于较低危患者。根据患者预后风险分层结果来制订辅助治疗方案是目前指南的治疗策略。
然而额外治疗的较佳时机尚不确定,故临床医生在决定术后立即治疗还是延迟治疗时,应根据患者的具体情况来判断。
在判断Ⅱ级少突胶质细胞瘤患者是否需立即接受术后治疗时,需考虑的因素包括:
1.是否存在肿瘤相关的症状;
2.是否有提示结局更差的危险因素:包括年龄≥40岁、术前肿瘤体大(如≥5cm)、不完全切除、组织学类型为星形细胞、MIB-1指数升高(>3%)、无IDH突变和无1p/19q联合缺失。
然而,单个危险因素是相对的(包括年龄≥40岁的临界值),并且存在生物连续性,认识到这点重要。此外,目前没有达成一致认同的低风险与定义,不同试验中有关风险的定义也各不相同。
Ⅱ级少突胶质细胞瘤全切后辅助治疗策略
1、观察的依据
对于大多数IDH突变伴1p/19q共缺失型Ⅱ级少突胶质细胞瘤全切或近全切的患者,建议在初次手术后采取“等待观察”的方法。与低级别星形细胞瘤相比,这类肿瘤的年增长速率较慢,一些患者可能多年都无需进一步治疗。手术无法治愈,可以预期这些患者较终会在病情进展时需要额外治疗。在这种情况下,推迟放疗对总生存(overall survival,OS)并无不利影响,还能推迟治疗的潜在毒性。如果患者不愿接受观察法的不确定性,则可选择术后立即治疗,不过这种方法的短期毒性更大。
值得注意的是,通常将年龄较大(如>40岁)和存在神经功能障碍作为立即行进一步治疗的支持依据,但这些都是预后因素,从未在前瞻性试验中检验过以明确哪些患者可能获益于早期治疗,对于遗传学一致的肿瘤。但是,由于关于放疗单用或联合丙卡巴肼+洛莫司汀+长春新碱(procarbazine,lomustine,and vincristine,PCV)方案治疗高危低级别胶质瘤的放射治疗肿瘤协作组(Radiation Therapy Oncology Group,RTOG)9803试验中,界定风险的纳入标准之一就是年龄>40岁,所以一些专家(包括NCCN共识指南)也采用此标准,以选择进行术后立即治疗的患者。
Ⅱ级少突胶质细胞瘤在全切后未治疗的自然病程基本是从早期研究得知的,这些研究混合纳入了IDH状态未知的少突胶质细胞肿瘤和星形细胞肿瘤。一项前瞻性研究中,111例<40岁的低级别胶质瘤患者基于外科评估认为实现了全切,2年和5年OS分别为99%和93%。组织学示纯少突胶质细胞瘤、残留病灶<1cm且术前肿瘤<4cm的患者,2年和5年无进展生存率(progression-free survival,PFS)分别为全切和70%。小型回顾性研究中,经分子学确诊IDH突变伴1p/19q共缺失型Ⅱ级少突胶质细胞瘤患者在全切后采取观察,生存率与上述相近。
2、监测间隔
监测通常包括术后1-2年每3-6个月做1次增强MRI,之后每6个月1次、持续数年,然后只要没有肿瘤复发的证据则每年1次。
少突胶质细胞瘤倾向于在切除腔的边缘局部复发,解读逐渐出现的微小改变可能困难。获得新的MRI影像后,务必用可获得的较早术后影像作为较相关的基线数据进行对比。有时医生可能需要几年时间才能肯定地确认,非增强T2/液体衰减反转恢复(fluid-attenuated inversion recovery,FLAIR)信号的微小改变或增加是明确进展,提示肿瘤复发。发现微小改变不表明需立即进一步治疗,特别是对于生长缓慢的病变,确定进一步治疗的正确时机可能很困难。
3、病情进展时的治疗
初次切除后采取观察的患者若肿瘤复发或进展,其治疗方案需个体化制定。治疗决策要考虑的因素包括:两次MRI对比的变化速率,肿瘤总体积,肿瘤在脑中的位置和可切除性,患者对进一步手术的意愿,有无对比增强,以及进展肿瘤的组织病理学分级。
其中一些较常见的情况如下:
•对于复发肿瘤体积相对较小且影像学未见增强的患者,或者不符合进一步手术的条件或不希望进一步手术的患者,我们通常进行放疗加化疗,按照Ⅱ级少突胶质细胞瘤的标准方案治疗。
•对于复发肿瘤体大或迅速进展的患者,通常需再次手术切除以减瘤、确诊和分级,是无病间期较长的患者和在完全分子分型之前确诊肿瘤的患者。然而,在用分子学技术将肿瘤完全分类的时代,可能不太需要组织学确认肿瘤级别,因为区分Ⅱ级和Ⅲ级少突胶质细胞瘤的治疗和预后意义已变得不太重要。
•对于大多数接受了再次切除的IDH突变伴1p/19q共缺失型少突胶质细胞瘤患者,术后治疗包括放疗和化疗,与下述新诊断患者相同。偶有少突胶质细胞瘤复发患者在全切后,选择再次随诊观察一段时间,之后再进一步治疗。
Ⅱ级少突胶质细胞瘤预后
预后尽管少突胶质细胞肿瘤的临床病程较长,但几乎都会因为肿瘤较终加速生长和对现有治疗耐药而缩短患者的生命。过去的人群研究或多中心试验发现,低级别少突胶质细胞瘤患者的中位OS为10-15年,10年生存率为51%。不过,这些估计值是基于2016年WHO分型以前的组织病理学诊断,当时WHO还未引入少突胶质细胞瘤的组织病理学和分子学综合诊断,而且包含了范围更广的肿瘤,其中许多肿瘤可能预后较差。根据关于放疗单用或与化疗联用的多中心随机试验的长期随访数据,存在1p/19q共缺失的Ⅱ级少突胶质细胞瘤患者经放疗加PCV化疗后的中位生存期可能接近20年。
特别注意:儿童Ⅱ级少突胶质细胞瘤术后可以放疗吗?
由于儿童对放疗的耐受性更差,特别是高剂量的放疗对患儿的生长发育造成严重的影响。24Gy以上照射可使智商下降,3岁以下患儿放疗后的智能损伤会影响其未来生存质量;丘脑下部-垂体放疗总剂量25~50Gy,即可发生发育障碍,乳汁异常分泌等垂体功能不全,一般在放疗后2~9年发病。生长发育期儿童椎体照射量达20Gy以上时,可出现明显的椎体发育障碍,由此造成受照射椎体的形状、大小异常。如患儿接受全脊柱照射,日后即可出现上身短、下身长的体型及由此而发生的胸廓畸形,甚至引起身高低于正常标准。同理如作一侧脊柱照射,可造成脊柱侧弯畸形,放疗颈部时,更易造成歪颈。在作脊柱照射及胸腹部肿瘤放疗包括脊柱时,脊髓通常不同程度地受到照射,如超剂量照射可能出现一过性放射性脊髓病,其典型临床表现为低头时向足跟部放射的麻木感。该症状可自愈,也可能继之出现肢体麻木无力、运动障碍,即为慢性放射性脊髓病的临床表现。因此,儿童放疗时注意限制总剂量,增加分割次数,尽量不合并化疗或尽量限制化疗药物的剂量,尽可能减少放疗的损伤。
近几年,技术的进步也催生了放疗领域的新式“武器”——质子束疗法(Proton Beam Therapy,也称质子治疗),相对比传统X射线放疗,质子治疗适用于胶质瘤、颅咽管瘤、髓母细胞瘤等多种脑肿瘤,能准确“打击”癌细胞且副作用小,进而有助于提高患者5年生存率以及生活质量,对于患者可以说是较为友好的“放疗利器”。对于儿童脑瘤患者来说,可以避免有常规化疗引起的听力丧失、认知功能障碍、智力影响等。
总结:
对于WHOⅡ级的低级别胶质瘤患者术后放射治疗的应用价值仍存在争议,主要在对术后放疗时机和远期放射性神经毒性风险。根据患者预后风险分层结果来制订辅助治疗方案是目前指南的治疗策略。
参考资料:
- 1、The 2021 WHO Classification of Tumors of the Central Nervous System:clinial implications.Neuro-oncology.2021.
- 2、2021 NCCN脑胶质瘤患者指南
- 3、doi:10.1002/cncr.31158

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号