血管中心性胶质瘤,又称血管中心性神经上皮肿瘤,血管中心性胶质瘤(Angiocentric gliomas,AG)是一种少见的难治性癫痫相关的弥漫性低级别胶质瘤。2021年五版中枢神经系统WHO分类中将其归入儿童型弥漫性低级别胶质瘤。血管中心性胶质瘤通常影响儿童和年轻人,有很强的致痫性,因为超过95%的患者存在顽固性癫痫发作。典型的位于额叶,血管中心性胶质瘤主要位于皮质,边界不清,有茎状延伸到白质中,朝向脑室。这个低级别的胶质瘤手术往往可治愈。那血管中心性胶质瘤有哪些症状?发病率高吗?应该如何诊断治疗?INC脑博士科普系列为大家重点梳理,关注INC国际神经外科医生集团官方账号,后期将放送更多精彩交流。
什么是血管中心胶质瘤?
血管中心性胶质瘤是一种弥漫性胶质瘤,主要由细的、细胞学温和的双较细胞组成,至少部分聚集在血管周围间隙。几乎全部血管中心性胶质瘤均有MYB::QKI基因融合,其余通常有另一种MYB改变(CNS WHO 1级)。
这种肿瘤好发于什么部位?
血管中心性胶质瘤通常位于大脑皮层,但脑干是该肿瘤越来越被认识的部位。
血管中心性胶质瘤有什么样的临床特征吗?
血管中心性胶质瘤患者通常表现为慢性和难治性局灶性癫痫,95%以上的患者有顽固性局灶性癫痫。头痛和视力障碍是其他常见的症状。
血管中心性胶质瘤的发病人群集中在哪里?
这种不常见肿瘤尚未获得基于人群的流行病学数据。大多数病例发生在儿童和年轻成人中,就诊时的中位年龄为13岁(范围:2-79岁)。目前尚无明显的性别偏好,但文献中描述的血管中心性胶质瘤男性患者略多于女性患者。
诱发因素有哪些?
多数血管中心性胶质瘤是散发的,与任何特定的危险因素无关。仅报道了与1型神经纤维瘤病和Koolen–de Vries综合征相关的单个病例,因此尚不清楚这些是否只是巧合。
发病机制是什么?
几乎全部的血管中心性胶质瘤携带6q23.3基因座MYB转录因子基因的重排。MYB较常与QKI融合,与中间区域缺失相关。更少见的是,MYB与ESR1、PCDHGA1或其他基因融合,或者发生扩增。血管中心性胶质瘤通常缺乏任何其他致癌突变或拷贝数改变,但已报道2个病例同时具有MYB::QKI融合和BRAF p.V600E突变{26810070}。在DNA甲基化谱研究中,血管中心性胶质瘤与其他含有MYB改变的肿瘤(例如儿童型弥漫性星形细胞瘤和弥漫性星形细胞瘤,MYB或MYBL1改变)聚集或接近。
MYB::QKI具有致癌性,并被认为通过MYB中负调控结构域的同时缺失、肿瘤控制因子QKI的功能性缺失和增强子易位迫使组成性活性MYB::QKI等位基因的表达来驱动肿瘤发生。MYB激活似乎驱动MAPK信号转导,与几乎全部儿童低级别胶质瘤一样;一项研究表明,MYB改变的肿瘤中MAPK通路的激活高于其他低级别胶质瘤,包括BRAF p.V600E突变的肿瘤。
在影像学上有什么表现?
在大脑皮层,血管中心性胶质瘤通常位于颞叶或额叶。脑干病例也有报道。在MRI上,这些肿瘤通常边界清楚,无对比增强,在T2加权和FLAIR图像上呈高信号。在某些病例中,T1加权MRI上肿瘤周围存在边缘样高信号。茎状延伸至相邻侧脑室和营养不良性钙化是其他可变特征。
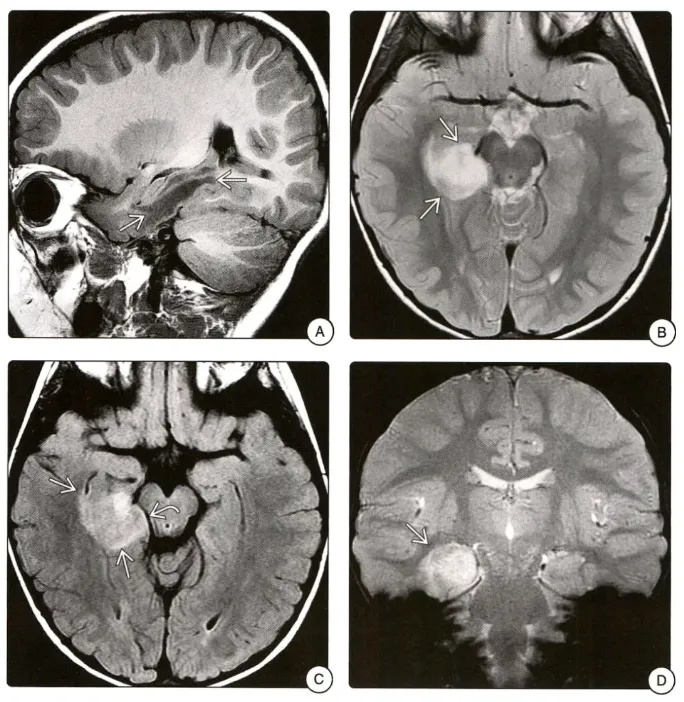
图A矢状位T1WI可见右侧颞叶低信号肿块。B轴位T1WI图像显示右侧颞叶边界欠清的高信号肿块。C FLAIR序列图像上病变呈高信号,并轻度肿胀,压迫邻近中脑。D冠状位T2*WI图像显示病变内未见提示钙化或出血的低信号。
有哪些辅助检查?
a.细胞学:少量单个细胞的组织碎片;双较细胞,细胞核长,斑块状染色质。
b.免疫组织化学:GFAP(+);EMA(+),点状,突出显示微腔。
c.基因检测:MYB::QKI融合/重排几乎见于全部病例;识别特征融合可能有助于异常解剖部位的确诊,如脑干。
d.电子显微镜检查:小管腔、微绒毛和纤毛;多个中间细胞连接。
肉眼检查如何分辨?
血管中心性胶质瘤受累结构扩大,皮层灰质-白质交界处模糊。它们可能会引起硬化,或者它们可能是软的和凝胶状的。可能发生囊性变,固体成分被描述为棕灰色。
显微镜检查下的特点?
组织学特征
•浸润性外观,但很少有神经元周围卫星灶
•细胞向血管的放射状(室管膜瘤样)和纵向方向
•软膜下栅栏样改变
•类似神经鞘瘤或室管膜瘤的致密区域
•不存在或偶见有丝分裂
•粘液样背景(部分病例)
•钙化和囊肿(少见病例)
•被捕获的神经元伴神经纤维改变(某些病例)
•高细胞密度(少见病例)
•微小、深色胞浆内微腔(不常见)通常需要IHC检测EMA
有哪些组织病理学的特点?
通常,血管中心性胶质瘤具有细胞学上均匀的双较梭形细胞,细胞核纤细,染色质呈颗粒状,定向分布于血管周围;这些细胞呈放射状排列,呈菊形团样模式,或沿血管轴纵向形成单层或多层袖套。梭形细胞成分可以广泛地以不同的密度渗透实质,形成神经鞘瘤样外观的致密结节,排列成紧密和相交的束状,并以水平流或垂直和栅栏状排列聚集在软脑膜表面下方。
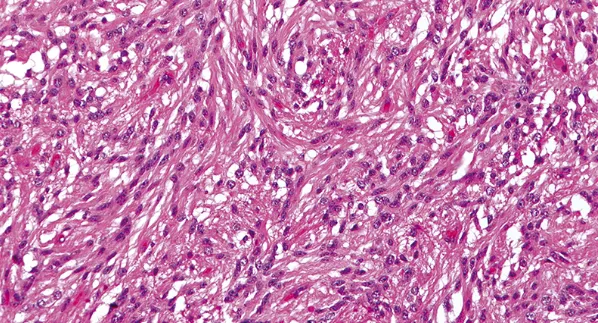
图示:在大多数血管中心性胶质瘤中发现了具有双较细胞质突起的伸长细胞,是在肿瘤的实性区域。
黏液样和微囊性改变可能很明显。被包埋的神经元没有明显的异形。一些血管中心性胶质瘤含有上皮样成分,可能含有圆形核旁结构和内部颗粒状点彩,这对应于在室管膜瘤中观察到的EMA免疫反应阳性微腔,并在超微结构水平上在血管中心性胶质瘤中得到证实。尽管出现了伴明显有丝分裂活性的组织学典型的病例,但在大多数情况下有丝分裂稀疏,且未观察到微血管增生或坏死。增殖活性增加和其他间变性特征的报道很少,但这些发现的临床意义尚不确定。
免疫表型
在免疫组化研究中,GFAP的表达是规则,一个近乎恒定的发现是细胞质至少区域EMA免疫标记呈点状或环状(微腔)模式。膜性EMA表达表征了血管周围和软膜下位置的一些上皮样细胞。肿瘤细胞不标记神经元标记物,与大多数其他低级别星形细胞瘤相反,主要是OLIG2阴性。Ki-67免疫标记指数值通常<5%(经常<1%),但在术后6年未复发的其他典型病变中发现标记指数为10%。
有什么分子病理学的特点?
实际上,全部血管中心性胶质瘤均显示6q23.3的MYB基因座发生重排和/或拷贝数改变,包括缺失或扩增。大多数重排涉及MYB和QKI基因之间的融合。在几项研究的数据中,74例血管中心性胶质瘤中有73例(99%)发生MYB改变。在可以进行适当分析的情况下,在这些系列的47个肿瘤中的41个(87%)中证实了MYB::QKI融合。
在少见情况下,MYB已被证明与其他几个基因融合,如PCDHGA1。血管中心性胶质瘤缺乏TP53、ATRX、IDH1、IDH2和组蛋白H3基因突变。另一种MYB改变频率相对较高的CNS肿瘤是儿童型弥漫性星形细胞瘤,MYB或MYBL1改变。
需要与哪些疾病鉴别诊断?
室管膜瘤
•大部分为实性,非浸润,边界除外
•血管周围假菊形团和的室管膜菊形团
室管膜下瘤
•离散、非浸润性
•无血管中心排列的结节状结构
浸润型星形细胞瘤
•无血管周围假菊形团或软膜下栅栏样改变
•IDH1 R132H(+),大多数病例ATRX损失
星形母细胞瘤
•大范围实性,非浸润性
•由上皮样细胞组成的血管周围假菊形团
•致密性血管硬化
毛细胞型星形细胞瘤
•实性,增强肿块
•具有嗜酸性颗粒小体和Rosenthal纤维的双相结构
异形性胶质瘤
•无血管中心外观或软膜下聚集
•更像弥漫性星形细胞瘤或发育不良
•在相同的甲基化簇内,有MYB或MYBL1改变而不是MYB:QKI融合
治疗预后情况
血管中心性胶质瘤通常具有惰性行为,并且在影像学上是稳定的。在大多数病例中,可以实现大体全切除并且是更好的。术后并发症和肿瘤复发不常见。无已知的预后或评估因素。
小结
血管中心性胶质瘤属少见胶质瘤,其好发于儿童的致痫肿瘤之一,虽属良性,但易导致药物难治性癫痫(medically intractable epilepsy),一旦确诊,要手术切除,效果好,全切后93%患儿癫痫可治愈,无需放化疗。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号