INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员、美国神经外科学院前主席、旧金山加利福尼亚大学(UCSF)神经外科系教授兼主席Mitchel S. Berger教授发表研究《Interactive Effects of Molecular, Therapeutic, and Patient Factors on Outcome of Diffuse Low-Grade Glioma》(分子因素、治疗因素和患者因素对弥漫性低级别胶质瘤预后的交互影响),以下为研究简述。


过去十年间,世界卫生组织(WHO)依据肿瘤组织学与分子特征将弥漫性胶质瘤重新划分为独立临床诊断类型。此类肿瘤包括IDH突变的星形细胞瘤(星形细胞瘤)和IDH突变伴1p/19q联合缺失的少突胶质细胞瘤(少突胶质细胞瘤),二者具有截然不同的临床病程。尽管生长相对缓慢,低级别胶质瘤(LGG)仍具有局部侵袭性,且易发生恶性转化。在2016年WHO对胶质瘤重新分类之前,"更广泛肿瘤切除与更长生存期存在关联"这一观点已被确立为标准诊疗原则。然而在弥漫性低级别胶质瘤(LGG)患者中,手术肿瘤切除范围(EOR)的作用存在争议。
研究方法
在一个包含392名IDH突变型2级胶质瘤患者的20年回顾性队列中,研究人员通过递归分区分析法,评估手术切除范围与分子及临床因素对总生存期(OS)和无进展生存期(PFS)的综合影响。总生存期结果在两个外部队列(n=365)中进行验证。对合并队列(n=757)进行倾向评分分析,以模拟具有不同切除范围水平的随机临床试验。
研究结果
研究分析确定三个生存风险组。中位总生存期最短的情况出现在星形细胞瘤患者的两个亚组:术后肿瘤体积(TV)>4.6mL的患者,以及术前TV>43.1mL且术后TV≤4.6mL的患者。中位总生存期居中的情况见于:术前TV≤43.1mL且术后TV≤4.6mL并接受化疗的星形细胞瘤患者;以及少突胶质细胞瘤患者中,那些术前TV>43.1mL且残余TV≤4.6mL,或者术后残余体积>4.6mL的患者。最长的中位总生存期见于:术前TV≤43.1mL且术后TV≤4.6mL、未接受化疗的星形细胞瘤患者;以及术前TV≤43.1mL且术后TV≤4.6mL的少突胶质细胞瘤患者。倾向评分分析表明,切除范围≥75%可改善生存结局。
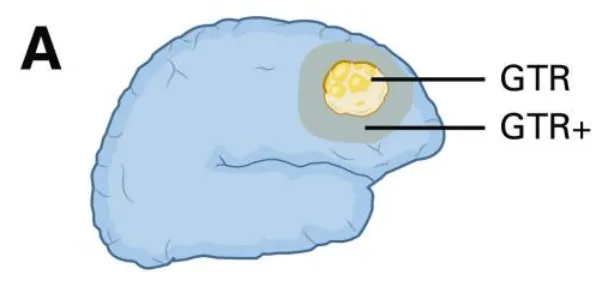
(A) 大体全切除及超全切除示意图:展示GTR(大体全切除)、GTR+(超越影像学肿瘤边界的切除)与GTR-(切除范围≤100%)的界定标准。
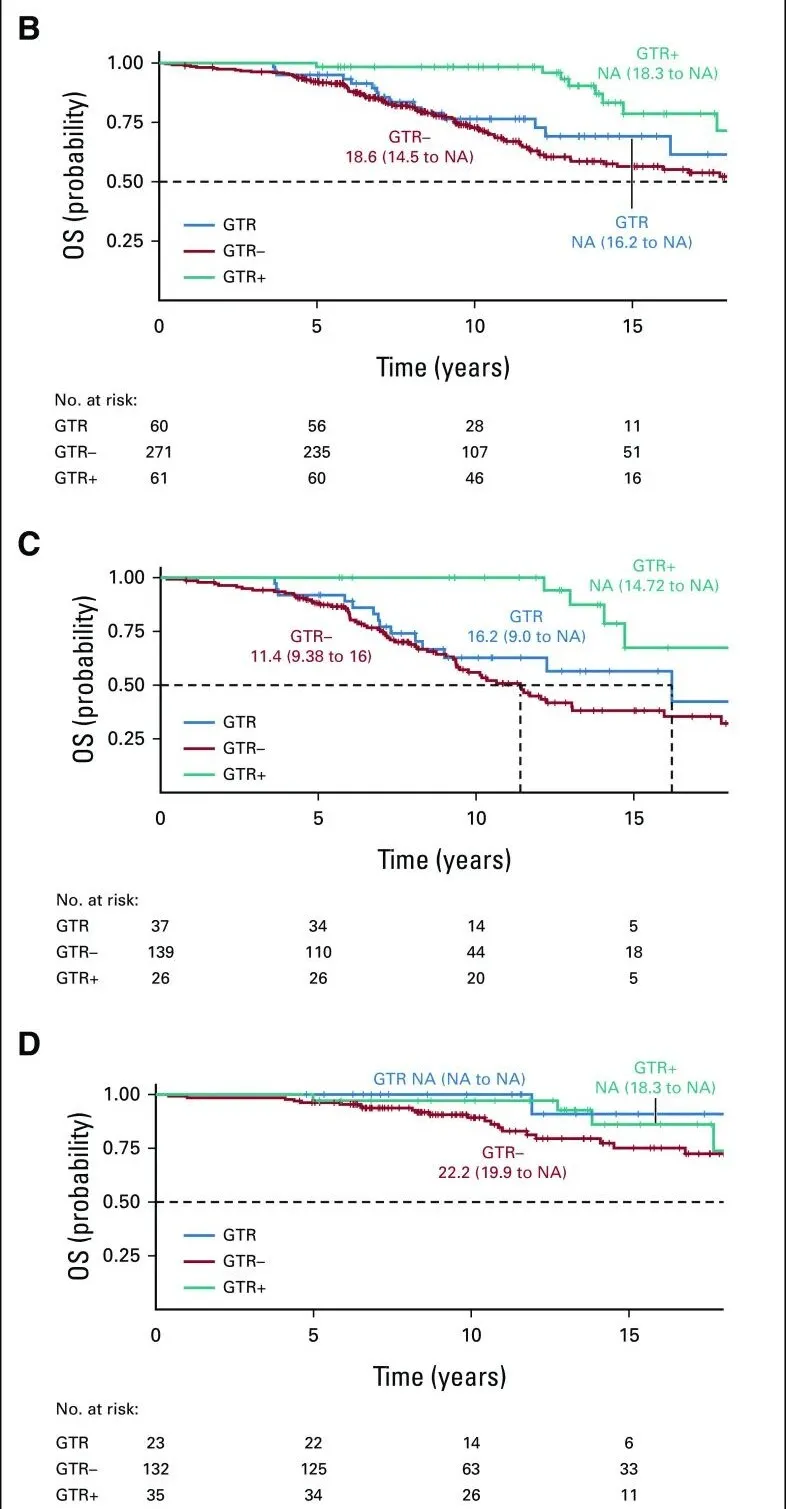
(B) 总生存期分析(UCSF队列):按GTR状态分层的Kaplan-Meier曲线显示,GTR+组患者总生存期显著延长(Tarone-Ware检验,P<0.001)。
(C) 星形细胞瘤亚组分析(UCSF队列):在星形细胞瘤患者中,GTR+同样与更优的总生存期相关(Tarone-Ware检验,P<0.001)。
(D) 少突胶质细胞瘤亚组分析(UCSF队列):该亚组中GTR状态未呈现显著生存差异(Tarone-Ware检验,P=0.11)。
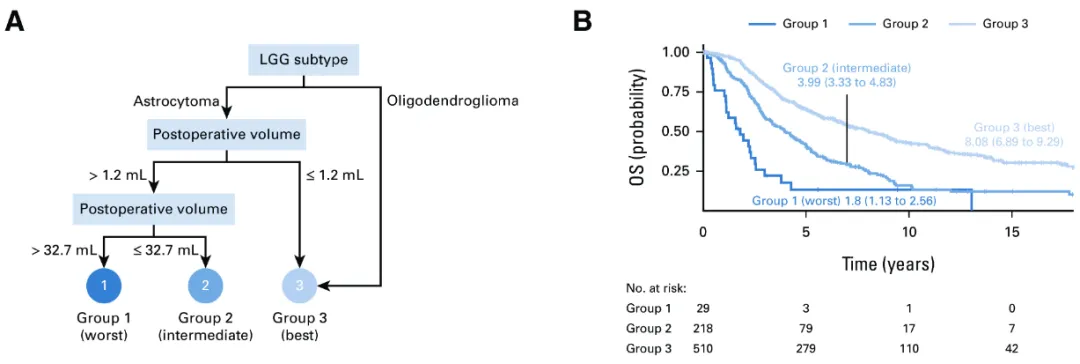
(A) 无进展生存期递归分区分析:基于术后肿瘤体积和低级别胶质瘤亚型划分出三个无进展生存期风险组。第一组(n=29)预后最差,为术后残留肿瘤体积>32.7mL的星形细胞瘤患者;第二组(n=218)预后中等,为残留肿瘤体积1.2-32.7mL的星形细胞瘤患者;第三组(n=510)预后最佳,包含所有少突胶质细胞瘤患者及残留肿瘤体积≤1.2mL的星形细胞瘤患者。
(B) 无进展生存期生存曲线:对应(A)中三组风险的Kaplan-Meier曲线(对数秩检验,P<0.001)。
(F) 多因素交互效应模型:显示切除范围≥75%可带来生存获益。
研究结论
弥漫性低级别胶质瘤治疗中,切除范围达到75%即可改善总生存期,而达到80%则可改善无进展生存期。尽管如此,在保留神经功能的前提下实现最大程度切除仍是治疗目标。研究发现对低级别胶质瘤(特别是少突胶质细胞瘤)的手术策略具有指导意义。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号