癌症如体内恐怖组织的反人类袭击,那在这场抗癌战争中,手术刀如"冷兵器",化疗便是"生化武器",放疗如"现代反恐技术"。这些手段都会在大脑上留下痕迹,因此影像学随访和评估是非常重要的,那影像学都有哪些重要的常见的影像学改变呢?

- 1. 治疗后假性进展
- 案例1:左胼胝体胶质母细胞瘤治疗后假性进展
- 2. 治疗后假性反应
- 案例2:左额叶星形细胞瘤治疗后MR上呈现假性反应
- 3. 脑转移瘤治疗反应标准
- 案例3:乳腺癌脑转移瘤,放疗后影像MR呈现部分反应疗效
- 4. 辐射诱发的血管损伤
- 案例4:放射性血管病变和放射性矿化性微血管病
- 案例5:转移瘤放疗后诱发海绵状血管瘤
- 5. 放射性脑实质损害
- 案例6:脑膜瘤放疗后脑实质放射性坏死
- 案例7:颅内转移瘤放疗后出现放射性脑白质脑病
- 6. 放疗后卒中样偏头痛(SMART)综合征
- 案例8:SMART综合征
- 7. 与化疗相关的并发症
- 案例9:伊匹单抗引起的垂体炎
- 8. 与手术相关的并发症
- 案例10:垂体大腺瘤术后出血、梗塞
- 案例11:胶质瘤术后脓肿
尽管脑肿瘤治疗后的影像学评估是相当具有挑战性的,但对现有的各种影像技术知识的了解可以帮助放射科医生区分治疗后反应和肿瘤进展,能在治疗中挽救病人避免不恰当的改变。此外,了解常见的治疗后在影像学上可以识别的并发症的相关知识,可以帮助放射科医生在预防病人并发症率和死亡率的方面发挥重要作用。本文就脑肿瘤治疗后的不同相关影像学表现作一综述,讨论现有的先进的磁共振影像技术和最常用于临床治疗的反应标准,同时提供关于在手术、放疗、化疗后影像检查中发现的大量并发症的综述。
治疗反应的标准
放射影像科医师有必要熟悉转诊临床医师用来评估患有脑肿瘤的患者的治疗反应标准。有很多这些方法中都严重依赖影像学,因此,放射影像科医生在指导临床治疗中起着重要的作用。尽管每个脑肿瘤的表现不同,组织学表现、进展也不相同,关注这两个脑肿瘤的主要种类是有帮助的:高级别胶质瘤和脑转移瘤。
高级别胶质瘤治疗反应标准
历史上,有多种不同的标准评估高级胶质瘤的治疗反应。Levin标准依赖于归因于治疗反应的肿块周围占位效应的质的改变。世界卫生组织(WHO)肿瘤反应标准依赖于治疗反应肿瘤大小的定量变化。然而,许多人很快就意识到这两个标准仅仅是描述肿瘤的视觉上范围的特点,没有考虑到临床上所看到的生物特征。1990年,引入的Macdonald标准,增加了所发现的与治疗反应有关的两个临床参数,包括:(1)类固醇激素需求量降低,(2)稳定或改善的临床状况。虽然比以前的标准好,但是Macdonald标准的影像部分有一个主要的弱点,在于只单纯依靠对肿瘤增强部分的改变的测量。正如前面所讨论过的,使用单纯对比增强后的序列并不是一种方法精确测量许多高级别胶质瘤范围的方法,因为肿瘤所具有的疾病的浸润性倾向,但可能不会出现增强强化。因此,在2010年发布的神经肿瘤(RANO)组织的反应评估标准强调T2 FLAIR序列在评估浸润性病变的非增强强化部分中的重要性。
实际上,在使用稳定或增加剂量的皮质类固醇激素时出现病变没有增强强化,现在T2 FLAIR的任何信号显著提高都达到疾病进展的标准。虽然在过去的几年里,已经公布了其他一些标准(例如,AVMglio和RTOG 0825),在临床实践中应用最为广泛的仍是目前的RANO标准。
除了RANO标准外,还有两种放射影像现象在文献中得到很好的描述,需要进一步深入地讨论。这里面包括假性进展(pseudoprogression)和假性反应(pseudoresponse)。
1. 治疗后假性进展
指最近治疗的脑肿瘤周边的新的发展或增强范围增大。这个影像表现最初类似肿瘤进展,但在随访影像上有改善或稳定,这个现象常被描述为在高级别胶质瘤在开始化疗后,大多为替莫唑胺(TMZ)和放疗后发生。
尽管对此的机制了解甚少,但这种情况是由于放化疗引起的局部炎症、脑水肿和短暂的血脑屏障的通透性增加,导致区域性的过度强化(hyperenhancement)。在成像时,通常会沿着病灶边缘出现厚而蓬松的增强,与存在存活肿瘤的区域相比,表观弥散系数(ADC)信号较高,脑血容量(rCBV)信号较低。
据报道,多达21%的使用替莫唑胺(TMZ)化疗的胶质瘤会发生假性进展,通常发生在治疗后2个月内,比单独接受放疗后发生放射性坏死的典型时间段要更早。
此外,值得注意的的是,表达O6-甲基鸟嘌呤DNA甲基转移酶(MGMT)启动子甲基化的高级胶质瘤通常更频繁出现假性进展。事实上,Balana等针对256名胶质母细胞瘤(GBM)患者的一项研究中,发现那些存在MGMT甲基化表达的会进展出现假性进展,相比真性进展假性进展增加3.5倍。此外,许多MGMT甲基化患者往往也有更好的总体结果,包括2年生存率提高和延迟出现复发的时间。这不仅对患者生存有重要的临床影响,也强调了对肿瘤的MGMT甲基化状态的了解,可能非常有助于影像解释区分假性进展和真性进展。
案例1:左胼胝体多形性胶质母细胞瘤假性进展
46岁男性,手术切除后的MRI显示一小部分沿切除残腔的前缘的小的不规则的强化(箭头所指)。
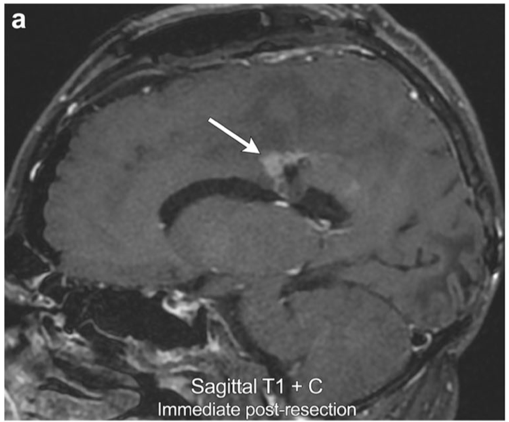
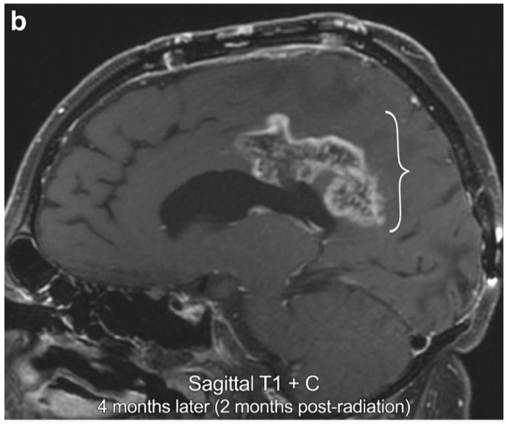
4月后(放疗后2月)MR显示瘤体外周显著增大的、残腔边缘强化,以后部为主(括号)。
切除术后8个月复查MR显示增强强化减弱(箭头),没有明显的灌注增高或弥散受限,一系列发现符合术后4个月有假性进展。
2. 治疗后假性反应
是指最近治疗的脑肿瘤快速的暂时的增强强化减弱。影像表现最初类似治疗反应,但仔细检查肿瘤常可见持久的T2 FLAIR高信号和表观弥散系数(ADC)低信号在随访影像上恶化加剧。增强强化的减弱可以发生的相当快,一项研究表明肿瘤血管大小的相对缩小最早发生在治疗的第一天。然而,同一个研究表明,在治疗的第56天大多数的这些患者会有血管大小逆转出现异常值。这一现象在接受抗血管生成药物治疗的高级别胶质瘤中有典型的表现,贝伐单抗(bevacizumab)和西地尼布(cediranib)通过抑制血管内皮生长因子(VEGF)起作用。然而,其他的治疗药物,如类固醇,也会有牵连。许多研究表明这种增强强化的减弱是由于治疗与相关的血管发生血管通透性改变,通过肿瘤血管渗漏的正常化而不是真正的肿瘤减少。
这进一步支持,事实上假性反应与6个月无进展生存率,而非总体生存率的显著改善相关。因此,非常重要的是,要知道,在解释胶质瘤治疗后的影像时所在使用的治疗药物,从而可以准确区别假性反应和真性反应。
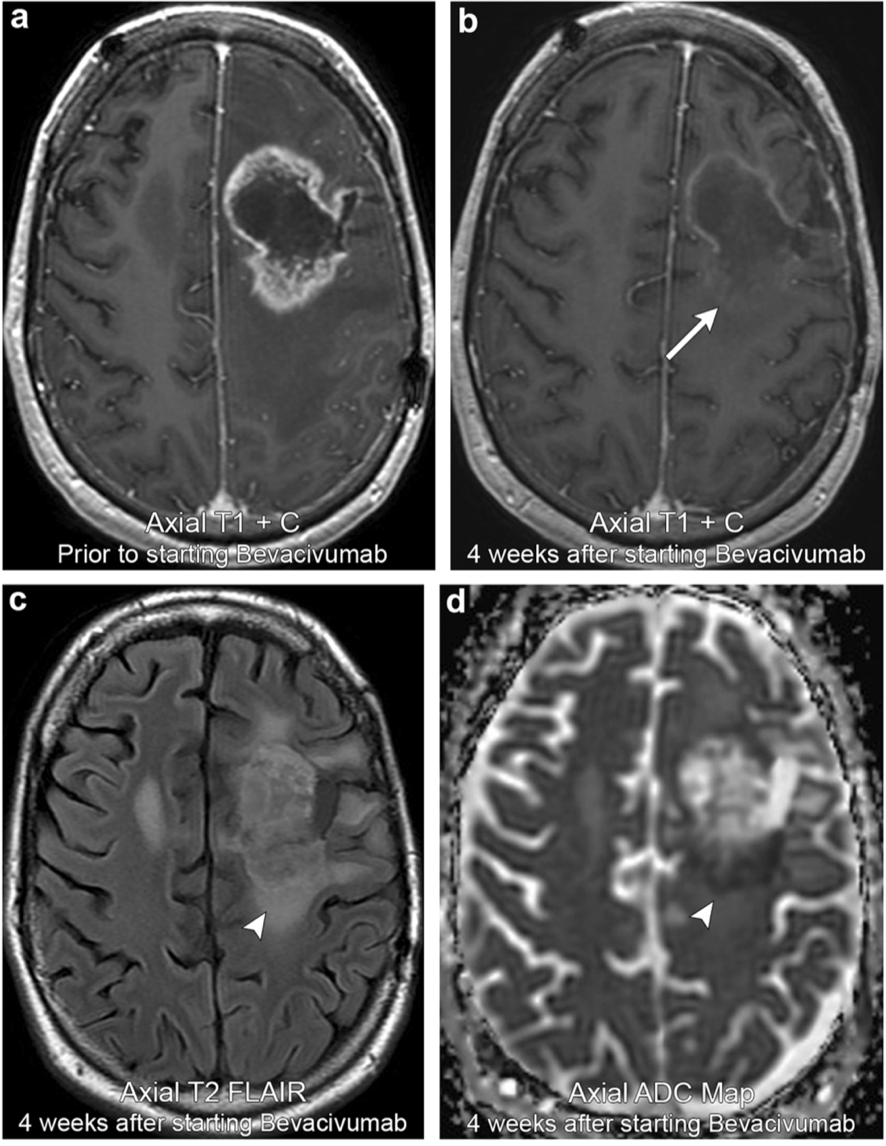
案例2:左额叶星形细胞瘤治疗后MR上呈现假性反应
38岁男性,确诊MR显示左侧额叶病变周围强化。开始贝伐单抗治疗4周后随访MR示增强强化显著的阶段性减弱(箭头所指)。然而,仍存在持久性T2 FLAIR高信号和表观弥散系数ADC信号减低(箭头所指)。系列后续成像表明T2 FLAIR中的高信号和肿块占位效应属于进展,确认为假性反应。
3. 脑转移瘤治疗反应标准
脑转移瘤是成人中枢神经系统恶性肿瘤中最常见的病因。尽管如此常见,但在文献中关于脑转移瘤的治疗和治疗反应的标准仍存在广泛的差异性。事实上,历史上,有很多临床试验真的会将脑转移瘤排除在纳入标准外。
为努力消除这种混乱和标准化地讨论中枢神经系统的转移瘤,在2015年神经肿瘤-脑转移瘤(RANO-BM)组织的反应评估工作组发布了脑转移瘤反应评估的标准。这些治疗标准聚焦于肿瘤大小和临床标准,如皮质类固醇的使用和临床恶化的客观测量。这些标准在很大程度上依赖于医学和放射影像学上的疾病进展,其定义是指病灶大小或出现任何新病灶>20%的增大。部分反应是指病变大小缩小≥30%,而疾病稳定则包括上述两者之间的一切病变。需要注意的是,这些标准仅限于脑实质内的脑转移瘤,而软脑脊膜和颅骨的转移瘤,通常情况下,客观地对其衡量和随访要困难得多。虽然中枢神经系统转移瘤现在开始被纳入到更多的临床试验中,关于神经肿瘤组织(RANO)的脑转移瘤的反应评估标准至关重要的是,提供一个框架以更有效地与转诊临床医生沟通。
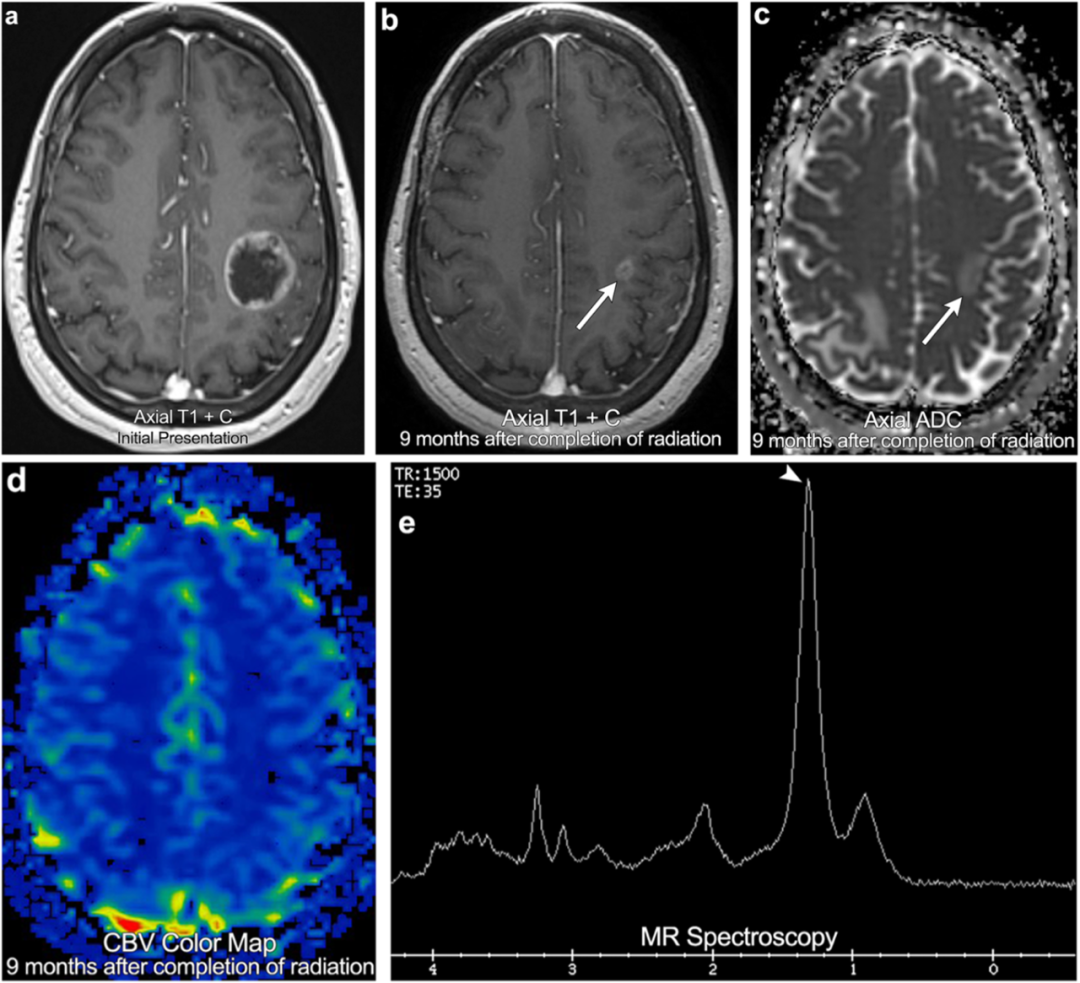
案例3:乳腺癌脑转移瘤,放疗后影像MR呈现部分反应疗效患者
55岁女性,乳腺癌。最初的分期MRI显示左额顶叶边缘增强的脑转移瘤,完成放疗(不使用类固醇药物)后9个月获得的随访MR显示脑转移瘤大小缩小>30%,无相关的表观弥散系数(ADC)低信号,且无脑灌注升高(箭头)。磁共振波谱显示天门冬氨酸NAA、胆碱和肌酸峰值受抑制以及脂质/乳酸峰值升高(箭头)。结果与部分反应相一致。
4. 辐射诱发的血管损伤
如前所述,放射会通过不可逆内皮损伤对颅内血管产生长远的影响。这是典型的迟发性损伤,在受照辐射后数月到数年才会显现。在影像上,放射性的血管损伤有三种主要表现:放射性血管病变,放射性血管增生性病变和放射性矿化性微血管病变(mineralising microangiopathy)。
放射性血管病变是指加速的血管壁的肌内膜增生导致不同程度的狭窄或闭塞。这个过程有一个会影响到脑的基底动脉的大血管的趋势,经常会有小动脉水平的检测逃逸(escaping detection on the arteriole level.)。在血管造影上,通常容易识别,因为受影响的血管只会位于受照射人通路处。对于中央部的肿瘤,如视神经胶质瘤或鞍区病变,床突上段颈内动脉和Willis环近端特别脆弱,经常产生烟雾病样的影像模式。值得注意的是,这些病人缺血和复发性梗死的风险增加。
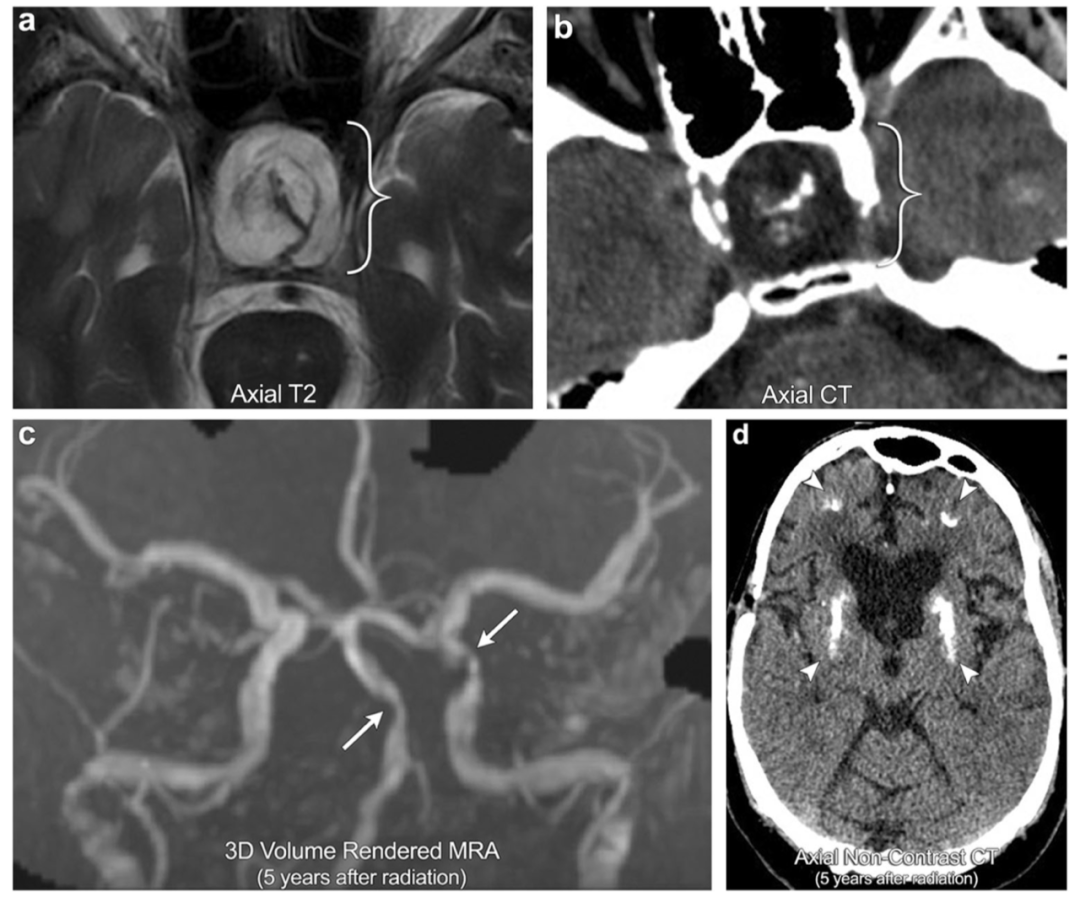
案例4:放射性血管病变和放射性矿化性微血管病
35岁男性,有放射史治疗颅咽管瘤的病史 (括号)。病人随后几年连续进展出现 多次卒中, MRA图像显示多个区域严重的 颅内血管狭窄,最明显的是基底动脉和左侧床突上段颈内动脉(箭头);这与放射性血管病变相一致。CT显示皮层下的脑白质和基底节区(箭头所指)出现 致密钙化,与矿化性微血管病变一致。
放射性血管增生病变包括毛细血管扩张和海绵状血管畸形(海绵状血管瘤)。这些病变的形成被认为是由脑微循环受损伤,触发局部区域的脑实质内新生血管生成所引起的。Larson等甚至假设这两种病变 存在于同一个病理谱上,放射触发增生路径导致毛细血管扩张形成海绵状血管瘤。组织病理学上,毛细血管扩张由薄壁的扩张毛细血管组成,脑实质正常分布在血管通道之间。在影像上,这些病灶表现为轻微的T2高信号和晕状增强信号,磁敏感成像(SWI)由于缓慢的流动和脱氧血红蛋白的数量增加显示低信号,有助于诊断这些病变。与毛细血管扩张相反,海绵状血管瘤由紧密堆积的未成熟的血管组成没有脑实质介入其内。在影像上,这些病变有产生微出血的倾向,产生混合的T1/ T2信号病变(呈“爆玉米花样外观”),在GRE/SWI序列上因含铁血黄素内衬呈开花状。
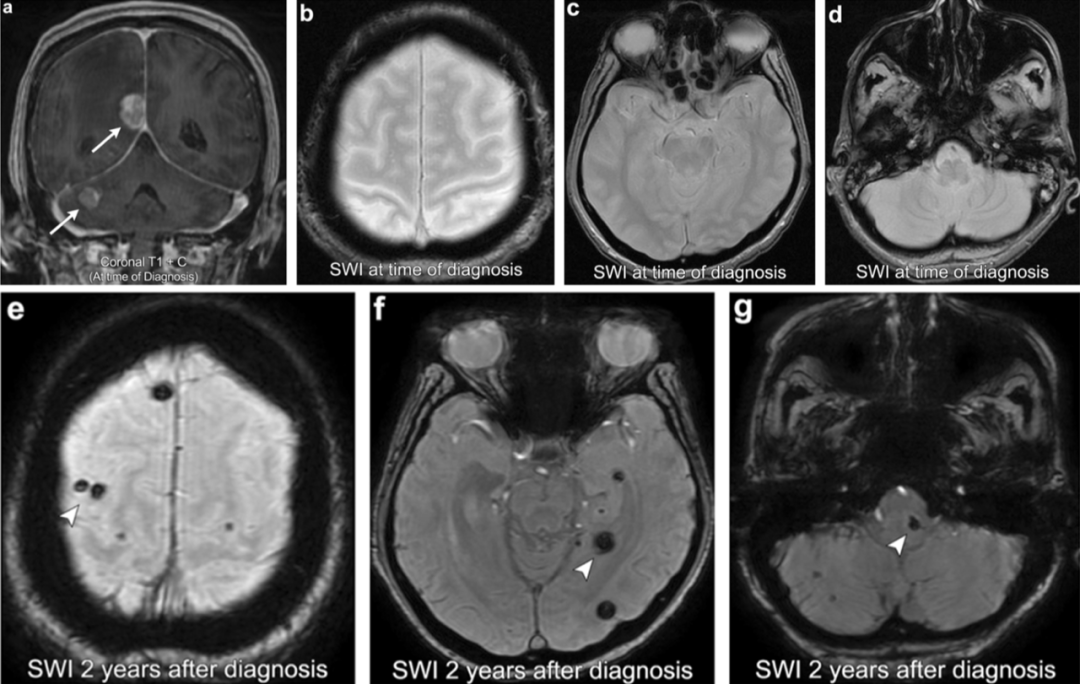
案例5:转移瘤放疗后诱发海绵状血管瘤
76 岁女性,有肺癌病史,出现多发性颅内转移瘤(箭头)。诊断SWI显示无局灶性异常T2星状低信号/在脑实质内的开花样变。在接受全脑放疗(WBRT)2年后,进行SWI成像显示多处新的异常局灶性T2星状低信号分散在脑实质内(箭头所指),与放射诱发的海绵状血管瘤一致。
放射性矿化性微血管病变指的是脑实质中进展形成的营养不良性微小钙化。组织病理学上,这一过程由受损血管壁以及周围的坏死脑组织的钙沉积组成。在影像上、钙化通常见于基底节和皮质下的脑白质,可能反映出小的穿通支和周围血管受到放射性损伤的遗传脆弱性。
5. 放射性脑实质损害
放射性坏死,指的是血管和脑实质的联合损伤导致的肿瘤或正常的脑实质的坏死,是一种迟发现象,会影响脑白质和以及相对保留浅表皮层的深层覆盖皮层。
放射性坏死的可能性取决于两个主要因素。首先是辐射时间,85%的患者发生在接受照射后的2年内。事实上,Shah等提出这个观点,完成接受放射照射后三年以上所发现的任何新的或恶化的异常,不太可能是单纯的放射性坏死。第二是照射剂量,随着普遍将照射剂量翻倍超过62Gy和4倍的照射剂量超过78Gy。
在影像上,很难将肿瘤和放射性坏死相区分,常常需要密切定期随访研究以观察增强强化是否恶化或改善。也就是说,有三种主要的影像形式高度提示为放射性脑实质损伤:
(1)沿切除残腔边缘新的增强强化,内部呈肥皂泡样(soap-bubble)表现,通常涉及到的组织以前没有增强强化;
(2)脑室周围局部增强但远离切除手术的残腔病远,但在照射的范围内;
(3)在照射范围内的局部增强病灶远离切除残腔部位,但没有沿着预想的肿瘤播散路径。
发生所有的情况中,先进的MRI成像有助于区分肿瘤与典型的放射性坏死,肿瘤常表现在强化区域通常呈现灌注影像上脑血容量(rCBV)降低,在磁共振波谱上脂质/乳酸峰值升高,在连续随访影像上增强强化缓解。
案例6:脑膜瘤放疗后脑实质放射性坏死
58岁男性,左蝶骨嵴脑膜瘤延伸至左侧海绵窦和眶尖(括号)。当时的左侧额叶基底部区域并无显著异常。放疗2年后的随访影像显示左侧额叶基底部区域几个不规则的边缘增强的病变(箭头)。无对应的异常弥散加权(DWI)信号。放疗后5年的随访影像显示左侧额叶基底部区域不规则的增强病变消失(箭头),确认放射性坏死。
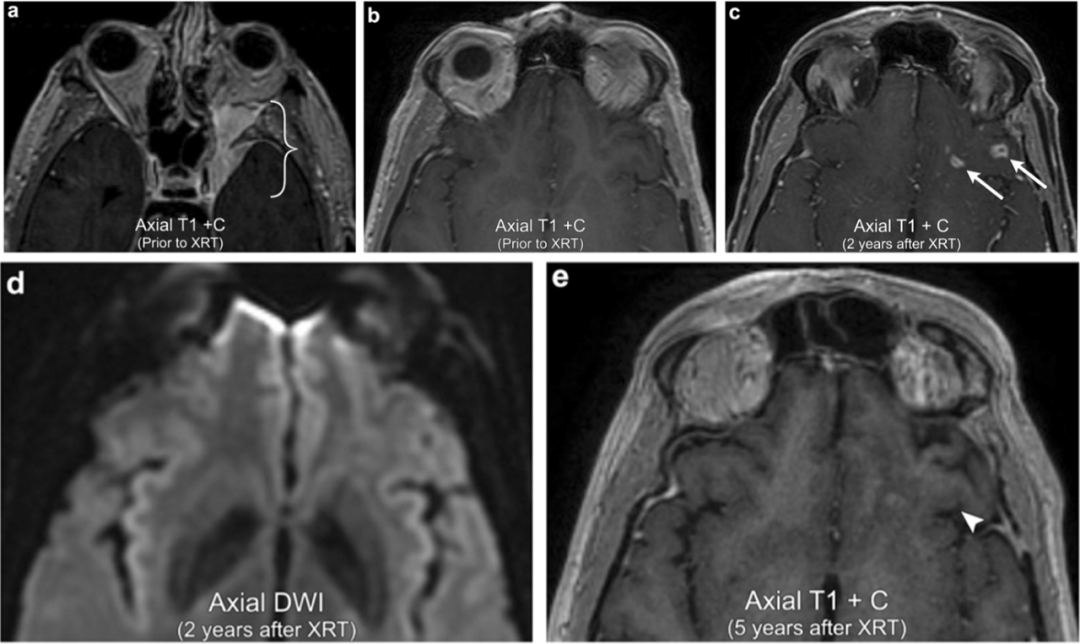
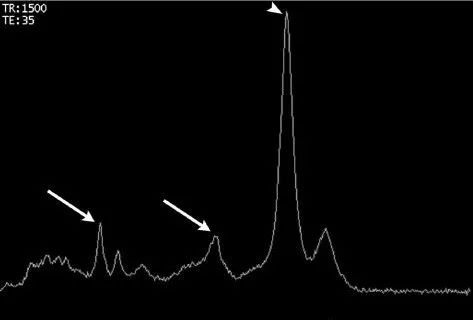
图:病理证实的放射性坏死的磁共振波谱图。胆碱、肌酸和乙酰天门冬氨酸(NAA)峰值下降(箭头),脂质/乳酸峰值升高(箭头)
放射性脑白质脑病是一个用来表示放射性脑白质损伤的术语,通常没有Frank坏死。与大多数形式的放射性损伤一样,尚不清楚病理生理学,但似乎是由直接的轴突损伤或血管损伤继发脑白质损伤造成。脑白质病的发生率也不清楚;然而,一项回顾性研究报告发病率,在接受全脑放疗(WBRT)治疗脑转移瘤随访6个月的患者中有34%出现脑白质病。临床上,患者表现为不同程度的神经认知能力下降,有许多患者在无症状时凭借影像诊断。事实上,影像学上脑白质改变和症状严重程度之间的关系尚不清楚。许多研究已经表明,其与认知能力下降程度的相关性很差。在影像上,放射性脑白质脑病呈现为进行性、对称、汇合的T2高信号主要涉及脑室周围的脑白质。值得注意的是,有些脑瘤患者也可能会由叠加药物引起免疫抑制,因此也有进展出现多灶性脑白质病(PML)的风险。虽然这种情况很少见,但纵观文献,在一些病例报告中已经描述过,重要的是影像能够区分两个脑白质实体。在放射性脑白质病中,与多灶性脑白质病不同,脑白质改变更加分散,并且倾向于保留皮层下的U纤维。
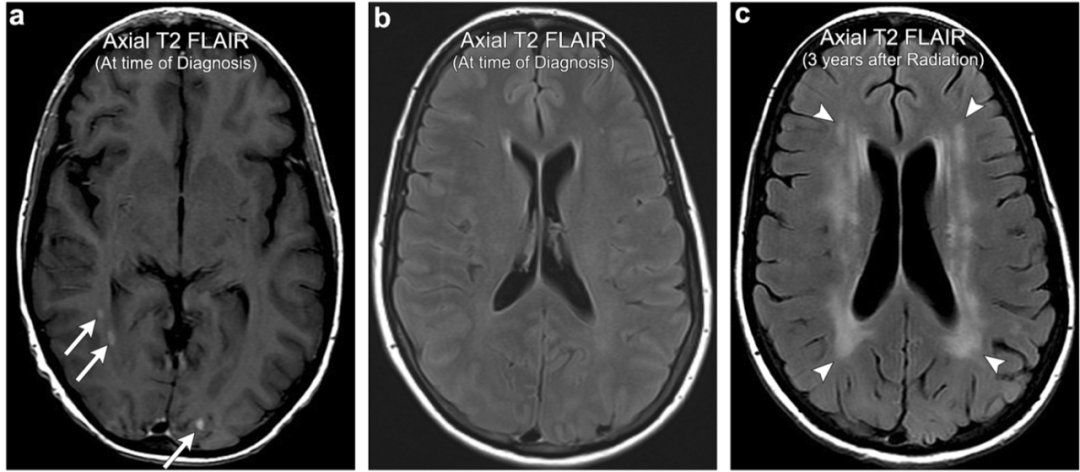
案例7:颅内转移瘤放疗后出现放射性脑白质脑病
47岁女性,有多发性颅内甲状腺癌转移的病史(箭头)。患者接受全脑放疗后,在随后的几年里,逐渐进展出现认知能力下降。全脑放疗3年后的影像显示广泛的脑室周围T2 FLAIR高信号(箭头所指),比预期的与年龄相关的微血管疾病广泛,符合放射性脑白质病。注意皮质下U纤维的相对保留。
6. 放疗后卒中样偏头痛(SMART)综合征
放疗后卒中样偏头痛(SMART)综合征是一种罕见的临床病症,在先前接受过放射照射后出现包括复杂偏头痛样的症状。多见于男性(男性与女性的比率为2.2∶1),通常有晚期迟发的现象,在接受50-64 Gy的剂量照射的患者中发生。
临床上,这些患者表现为偏头痛,常伴有恶心、呕吐和对光敏感反应。此外,33-74%的患者有局灶性神经功能障碍,70 - 82%的患者会出现癫痫发作。对放疗后卒中样偏头痛(SMART)综合征的发病机制知之甚少,认为是多因素的病因造成。一些作者提出放射性血管损伤产生可逆的血管调节障碍从而导致血脑屏障破坏和脑水肿,类似于后部可逆性脑病综合征(posteriorreversible encephalopathy syndrome,PRES) 。然而,其他作者如Farid等通过使用Tc-99 m HMPAO SPECT检测,对比发作时的(ictal)和发作后的(poststictal)脑灌注,则表示出现SMART综合征临床症状的患者属于正常的脑血管反应。他们反对这是一种血管性机制,而是神经元功能障碍的一部分。在影像上,典型的SMART综合征显示T2高信号,且有些患者增强后显示弥散受限。通常涉及大脑半球后部或小脑,一般会在随访影像上改善或缓解。
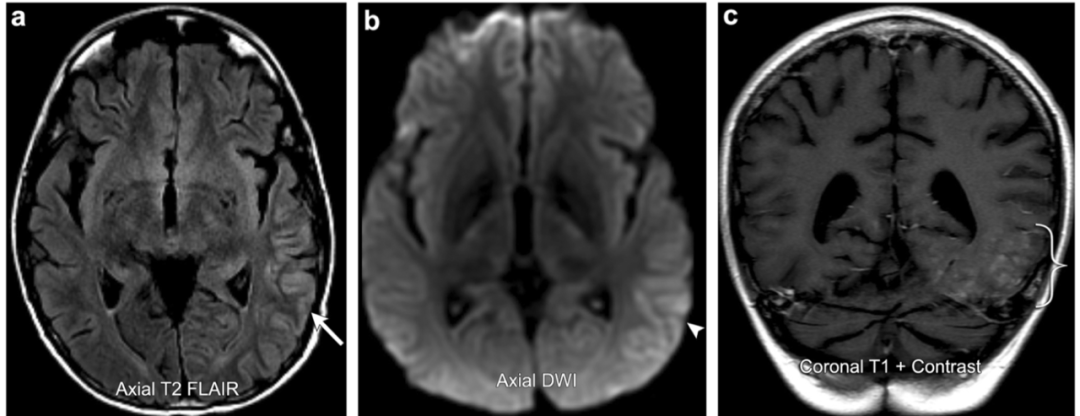
案例8:SMART综合征
31岁男性,10年前后颅窝非典型畸胎样横纹肌肿瘤切除术及放疗病史,现在出现持续性头痛,视野缺损,一天来出现找寻词语困难。磁共振图像显示脑回增厚和T2 FLAIR信号增高涉及到的左颞叶、顶叶和枕叶的大部分后方皮质(箭头所指)。伴有轻度弥散受限(箭头)和脑回增强(括号)。随访脑电图无癫痫活动和后续症状得到缓解。影像学表现及临床过程与SMART综合征相一致。
7. 与化疗相关的并发症
化疗药物对不同的中枢神经系统的结构都有直接的毒副作用。特定的中枢神经系统结构受到影响和具体程度的变化,取决于所使用的药物和所给的剂量。鉴于新化疗药物的种类数量不断增长,每一种都有自己的毒副作用情况,进行彻底的中枢神经系统药物毒副作用的讨论超出了这篇文章的范围。然而,话虽如此,却显示出大多数药物倾向于影响相似的结构并且会产生相似的影像上出现损伤的模式。此外,某些药物可以导致典型的病理影像学表现(即,伊匹单抗ipilimumab诱发的垂体炎),一旦熟悉它们的影像表现,就容易诊断了。
文献中被广泛地描述为,所有的中枢神经系统的结构中,脑白质特别容易受到药物的伤害。尽管对这个机制的发生知之甚少,有人认为特别是在神经行为通路中,有白细胞毒性(leukotoxic)的药物会导致神经传递的破坏,往往导致经典的临床表现为“精神状态改变”。这个损伤会导致药物所致中毒性脑白质病,产生类似于放射性脑白质病的临床和影像学表现。事实上,以往进行过的讨论中,提到许多化疗药物真的会让以前的辐射损伤加重。临床上最常用的白细胞毒性药物是甲氨蝶呤(methotrexate);然而,许多其他药物包括卡莫司汀(carmustine),顺铂(cisplatin),阿糖胞苷(cytaribine),氟尿嘧啶(fluorouracil), 和白细胞介素2(interleukin-2)也有涉及。
神经毒性的发生率是相当多变的;然而,处理对应方法已被证明是重要的。Filley 等说明中毒性白质脑病可发生在低于10%的使用静脉注射甲氨蝶呤治疗的患者中,但使用鞘内甲氨蝶呤治疗的患者中会高达40%出现使用静脉注射甲氨蝶呤治疗的患者。在影像上,化疗相关的脑白质病通常会在额顶叶脑白质出现不增强的T2高信号,但有时可以表现为分散的脑室周围和深部额脑白质受累,类似于放射性脑白质病。在磁共振弥散加权(DWI)上,急性期患者可见局部的或弥散的区域可逆的弥散受限。通常情况下,中断所给引起毒性反应的药物后症状会随着时间的推移而改善。
另一个常见的与化疗相关的并发症讨论是伊匹单抗(ipilimumab)性垂体炎。伊匹单抗(Ipilimumab)(MDX-010)是一种单克隆抗体,其作用原理是抑制细胞毒性T淋巴细胞相关抗原4.增强病人的免疫系统以产生对恶性肿瘤细胞的反应。这个药物特别对转移性黑色素瘤和肾细胞癌有效,现在被广泛用于出现疾病播散的患者。然而,增强免疫反应可以对全身引起许多不良的自身免疫反应,如结肠炎,皮炎,和关节炎,等等。
在中枢神经系统,文献中伊匹单抗(ipilimumab)诱发的垂体炎是比较好辨识的自身免疫反应。尽管有认为只发生在小于5%的接受伊匹单抗治疗的患者。这些患者临床上可表现为威胁到生命的激素失调,特别是高皮质醇激素增多症。在影像学上,伊匹单抗诱发的垂体炎导致弥漫性垂体的增大,常为T1加权成像低信号,漏斗部增厚/增大。停用伊匹单抗后随访影像和类固醇的引入使用后典型的表现为异常发现的完全消失与垂体复原到基线外。这种影像上的好转与临床上的症状和激素水平的变化好转相一致。重要的是,许多患者会继续进展出现不同程度的垂体功能减退,需要激素替代性治疗。
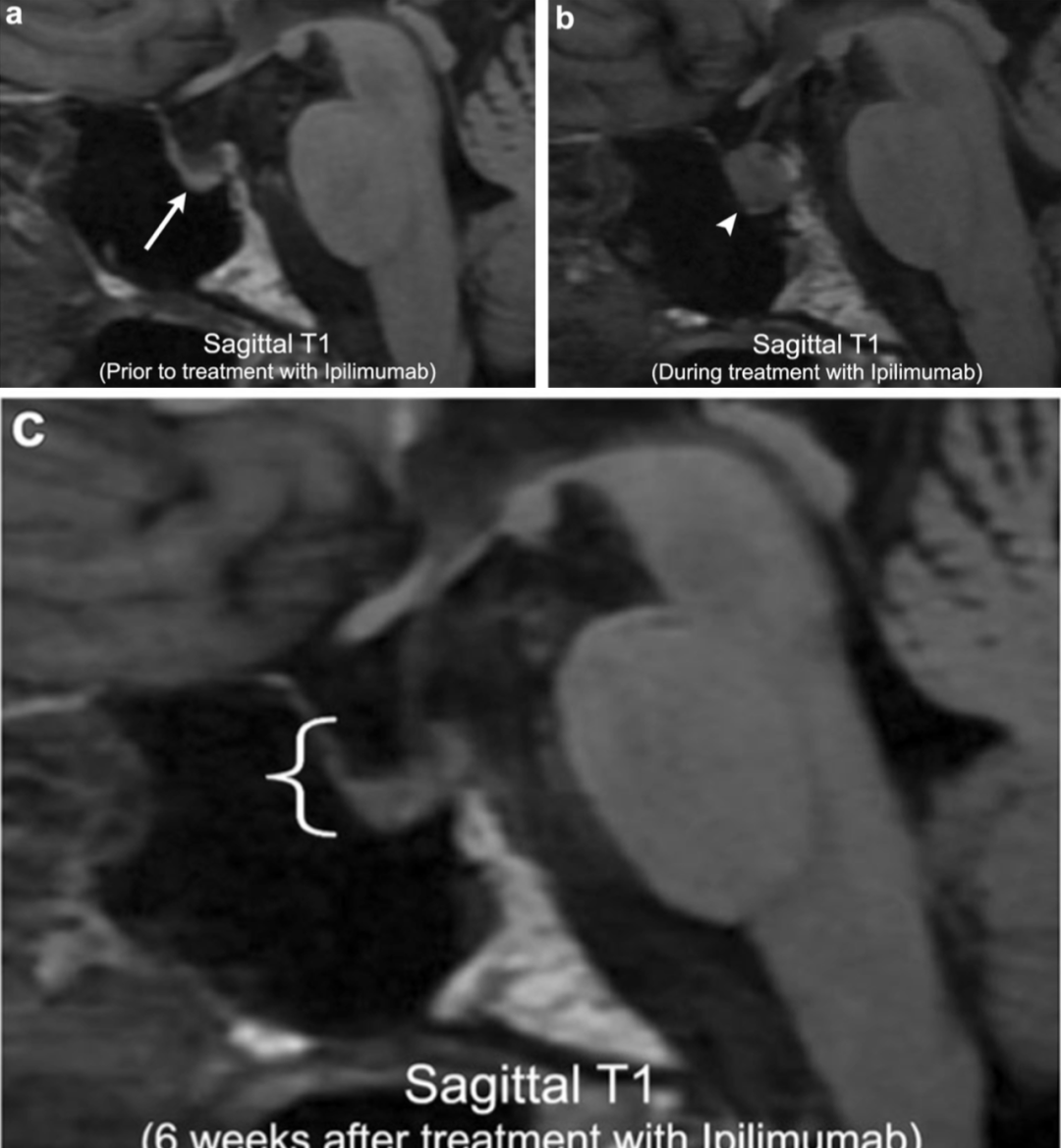
案例9:伊匹单抗引起的垂体炎
63岁男性,转移性黑色素瘤患者。初始的影像显示部分空蝶鞍与其他方面正常的垂体腺(箭头)。开始伊匹单抗治疗后,有标记异质性增大的垂体(箭头)同时伴有伊匹单抗引起的垂体炎。中止伊匹单抗治疗后6周的影响显示垂体的增大豪装(括号)。然而,病人当时出现全垂体功能低下。
8. 与手术相关的并发症
手术切除是多种类型脑肿瘤的最重要治疗,尤其对于高级别的胶质瘤,大型脑转移瘤或轴外病变,有显著的占位效应。
最常见的术后并发症是医源性卒中(iatrogenic stroke),医源性卒中的住院死亡率风险增加了9倍,进展出现缺血性病变的风险与肿瘤靠近中央穿支动脉有关。
第二常见的术后切除并发症是颅内出血,颅内出血带来的住院死亡率增加三倍,可能需要根据出血的程度再次手术。
相比梗死和出血,切除后感染是一个少见的罕见并发症,通常见于免疫状态低下的患者。临床表现为骨瓣感染,硬膜下积脓、脑炎、脓肿(图18),以及脑膜炎(发病率约0.1%)。尽管相对罕见,早期认识这些术后并发症是为了避免严重的并发症率/死亡率。
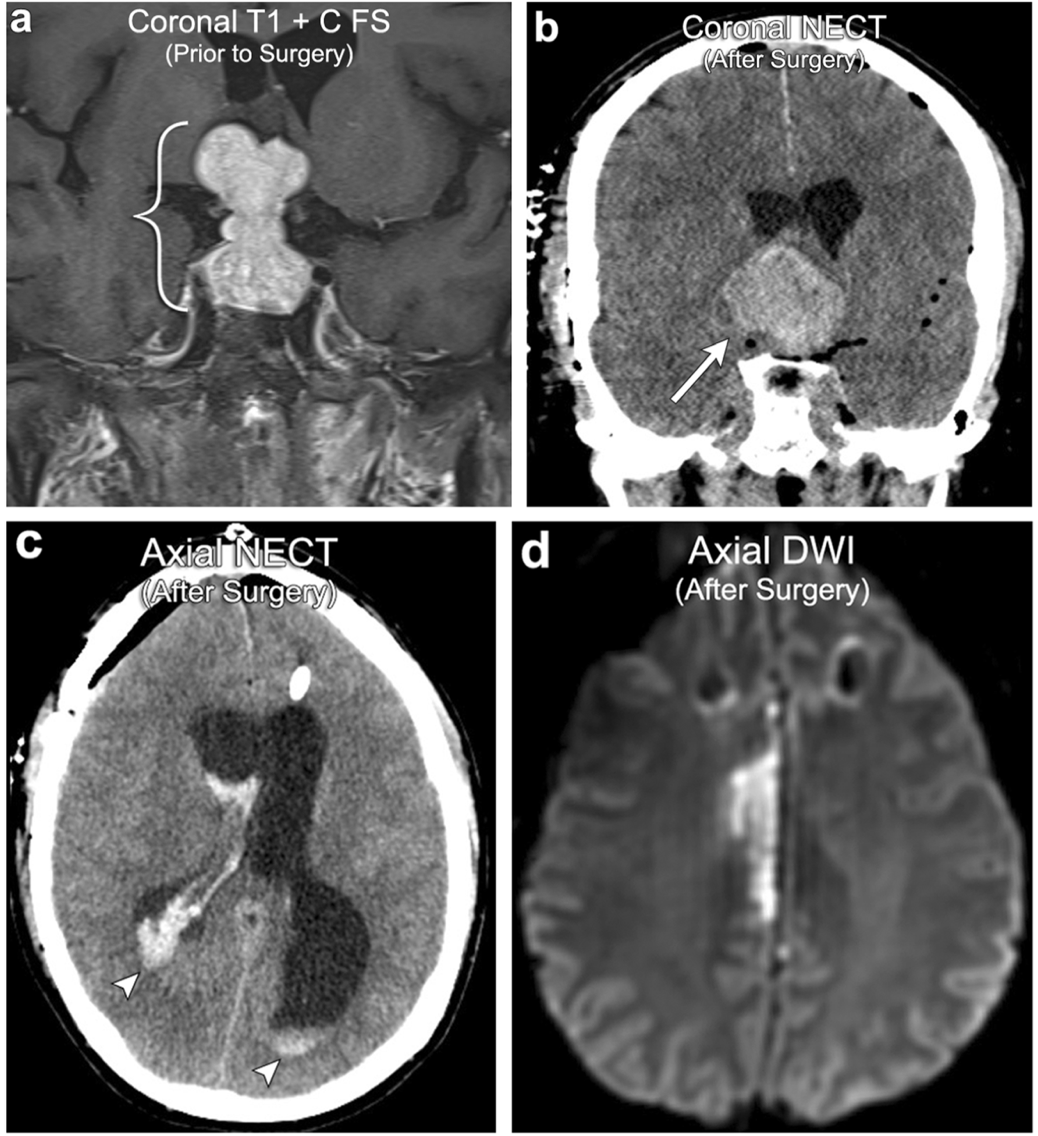
案例10:垂体大腺瘤术后出血 、梗塞
52岁男性,垂体大腺瘤(括号)。大体切除术后的MR显示残留腺瘤的出血扩大与垂体卒中(箭头)一致。还有脑室间的出血扩展(箭头)。随访MRI显示由于垂体腺瘤出血增大后的右侧大脑前动脉受占位效应导致右侧大脑前脑动脉(ACA)供血区域梗死。
图为术后并发症:
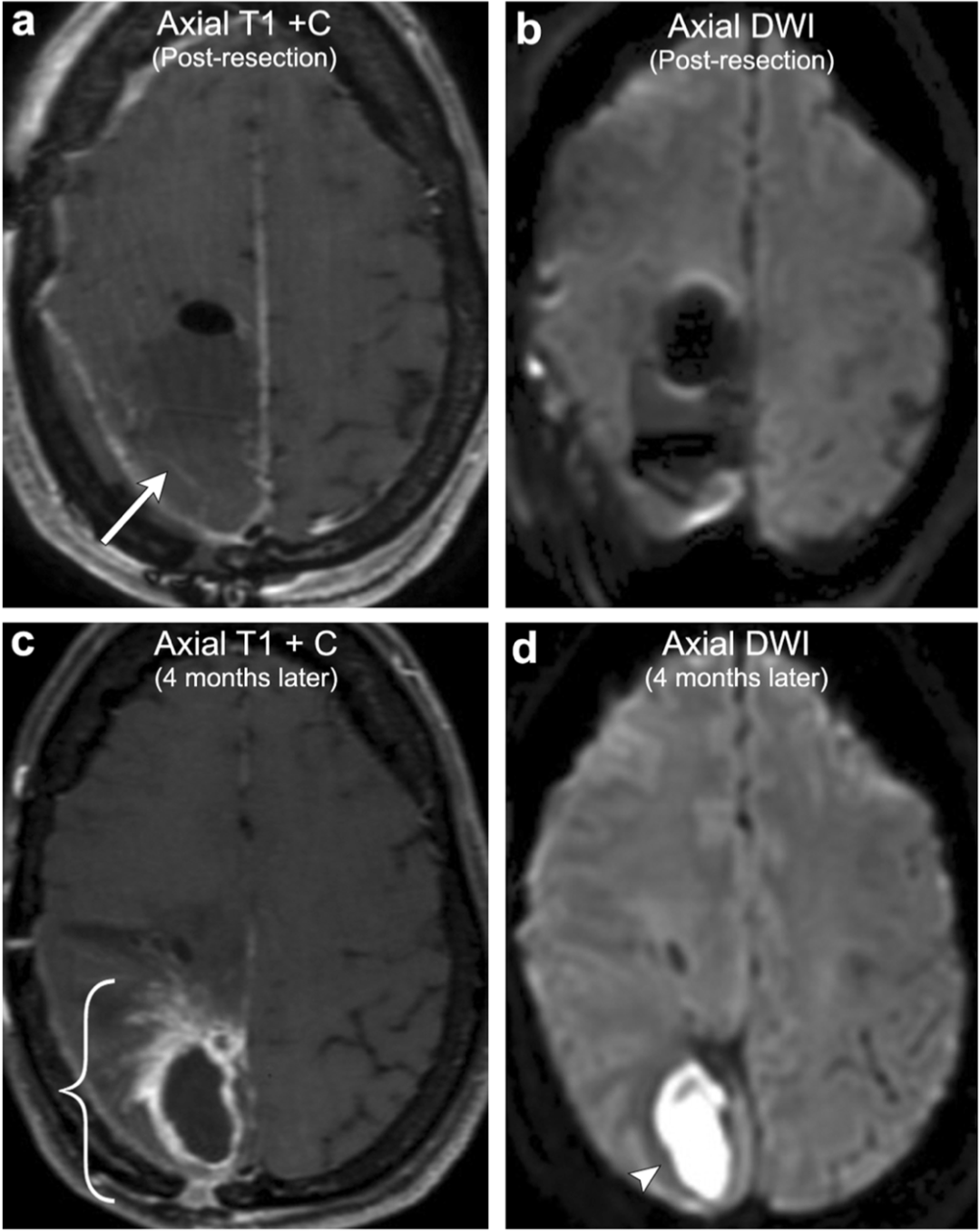
案例11:星形细胞瘤术后脓肿
45岁女性,有右顶叶间变性星形细胞瘤切除术史。初始切除术后的影像显演示微弱的边缘增强的手术残腔(箭头)和无内部弥散受限。大约4个月后,患者描述一个持久的手术部位“结痂”,且越来越头疼,和个人感觉发热。重复影像检查像显示边缘增厚增强强化(括号)内部弥散受限(箭头,符合脓肿形成,术中确认。
要点
•在许多低级别或浸润性胶质瘤中,对比增强影像MR并不能可靠地确定肿瘤的范围。
•动态敏感性对比增强(DSC)灌注加权成像中局部区域的脑血容量(rCBV)升高提示肿瘤生长/复发。
•脑肿瘤治疗反应标准依赖于影像学表现和临床参数。
•化疗药物可以增强多种形式的放射性损伤。
•伊匹单抗(ipilimumab)诱发的垂体炎会导致暂时的垂体弥漫性增大。
在日常实践中的神经成像中,常见原发性和转移性脑肿瘤。目前可用于治疗这些肿瘤的广泛组合的治疗方案,使治疗后的成像的解释变得相当复杂。了解治疗后成像技术,治疗反应标准,和常见的与治疗相关的并发症能让解决这类挑战性的议题的方法变得简单。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号