低度恶性胶质瘤脑瘤是儿童中常见的脑瘤。这些肿瘤的治疗取决于几个因素,包括患者因素(如患者年龄和共病)和疾病特征(如肿瘤位置和组织学亚型)。选择治疗方法需要仔细考虑较小化手术、化疗和放疗的晚期毒性。治疗副作用可能是长期性的或威胁生命的,包括神经认知障碍、神经功能缺损、神经血管损害、神经内分泌缺陷和二恶性肿瘤。手术,放射治疗和化学疗法可用作单独疗法或组合疗法,根据设置提供不同的治疗比例。因此,建立理想的治疗选择和测序在历史上一直是一个有争议的领域,提出的挑战因分子靶标的出现而变得更加复杂。

相关阅读:脑瘤出国质子治疗热门目的地:法国居里癌症研究所质子中心
若干研究试图通过选择性地避免辐射、有系统地缩小目标体积和使用前沿的辐射技术来减轻晚期辐射毒性的影响。在这些放射技术中,质子治疗特别有前途,因为它可以减少靶区以外正常组织的中低辐射剂量。因此,根据美国放射肿瘤学协会模型政策,儿童LGGs(低级别胶质瘤)被认为是质子治疗的“1组”适应症,已成为国际范围内三常见的儿童脑瘤种。
尽管如此,较近只有描述病人结局的小型异质性研究被发表。鉴于对儿童LGGs放射治疗方式进行随机研究的可能性很低,结果研究继续帮助确定质子治疗相对于其他技术的治疗比例,并完善其相对于手术和化疗的治疗价值。
低级别胶质瘤质子治疗相关研究报告
2006年9月至2018年8月一项关于质子治疗的研究,1624名儿童患者(年龄≤21岁)接受了质子治疗。174名儿童患者被确诊为非转移性LGG,并进行了至少6个月的潜在随访。接受过放射治疗的患者被排除在外。肿瘤的总体体积是由放射治疗时的总体疾病来确定的。临床目标体积(CTV)的定义是肿瘤总体积+5mm,必要时可以进一步修改,以覆盖较初与肿瘤接触的全部表面。用于规划目标体积(PTV)的扩展为均匀的3mm,用于日常图像引导。标准的处方剂量是54 GyRBE。然而,在2012年6月,机构治疗指南被修改为对脊髓或脑干LGG的儿童分娩50.4 GyRBE。2016年6月,该剂量修改范围扩大到全部≤5岁的儿童。129名患者(74%)接受了54戈瑞。
辐射计划的主要目标是确保整个CTV被标称剂量的99%覆盖,整个PTV被标称剂量的95%覆盖。目标覆盖范围逐例修改,以限制脑干、脊髓或视交叉的剂量。全部患者均采用双散射质子计划治疗。
58%的肿瘤为WHO1级,30%为WHO2级。常见的组织学是毛细胞星形细胞瘤(47%)。常见的肿瘤亚位点是间脑/视神经通路(52%),脑干(16%),以及小脑(13%)。较初诊断时的中位年龄为6.3岁(范围0.3-20.4岁)。
疾病控制结果
中位随访时间为4.4年(范围0.5-11.4),5年精算无进展生存总生存率分别为84%(95%可信区间,77%-89%)和92%(95%可信区间,85%-95%)图2)。在21例、2例和1例患者中,进展的一个部位分别是局部的、转移的或同时的。5年精算局部控制率为85%(95%置信区间,78%-90%)。我们没有观察到任何边缘复发。在肿瘤生长的患者中,局部进展的中位时间为1.0年(范围为0.3-4.4年)。共有3名患者在治疗后1年、2年和3年失去随访。
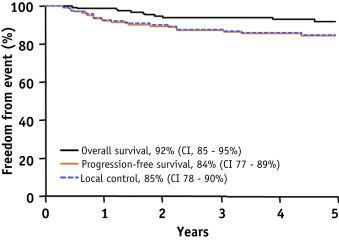
图示:精算总体生存率、无进展生存率和局部控制率的五年比率。
在单变量分析(表1),只有诊断时的年轻年龄与生存率的提高相关:具体来说,儿童的5年总生存率为97%,而老年患者的5年生存率为86%。毛细胞型星形细胞瘤患者的5年生存率为大概率,而其他组织学亚型为84%,但这种较大的观察差异没有统计学意义。年纪和组织学与更好的局部控制或无进展生存无关。仅仅放射疗法剂量和肿瘤亚位点与局部控制和无进展生存相关。小脑或大脑半球LGG病或幕上脑中线肿瘤患者的局部控制和无进展生存率为90%,而脑干或脊髓胶质瘤患者为62%。
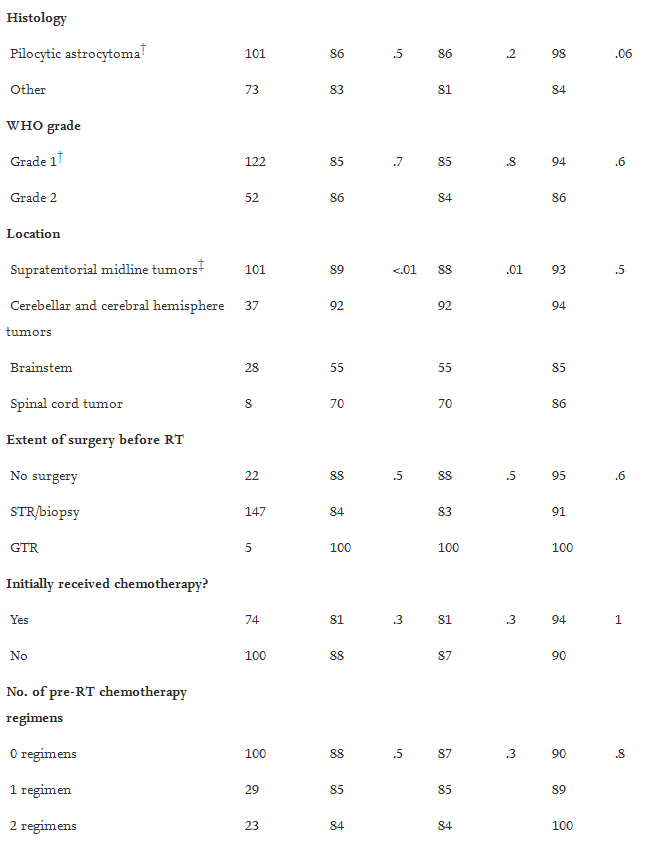
表1:与疾病控制相关的潜在因素的单变量分析
毒性
2级急性胃肠毒性22例(12.6%)患者出现恶心或呕吐,需要进行放射治疗昂丹司琼;这些患者中只有2人(1.1%)需要地塞米松辐射后逐渐变小。两名患者(1.1%)出现需要阿片类镇痛的头痛(2级)。两名患者(1.1%)患有肿瘤囊肿,在放射治疗期间需要经Ommaya引流,一名患者在治疗期间需要脑室分流术。7名患者(4%)观察到放射治疗引起的严重晚期毒性。
在没有肿瘤进展或假进展的患者中,1例视神经通路胶质瘤患者经历了的长期性视觉障碍因为视网膜病。39名患者(22%)出现新发中枢神经系统激素缺乏症辐照后(2级毒性)。几乎全部这些患者(n=37)都有累及视通路的幕上中线肿瘤,丘脑,和/或顶盖。受影响常见的激素是生长激素在31名患者中有缺陷。四个病人有部分感音神经性听力损失辐射后1耳(2级毒性),其中1耳需要助听器(3级毒性)。6名患者(3.4%)有无症状性血管病变(1级毒性),表现为海绵状血管瘤(2例)、轻度血管狭窄(3例),或微钙化(n=1)在照射区域。
讨论
儿科LGGs的管理是一个不断发展且经常有争议的话题。前瞻性和回顾性研究表明放射治疗在大多数儿童中提供合适的长期疾病控制,但是辐射毒性对其使用产生了有限的热情,是在儿童患者中。年龄也是目前关于放疗在治疗算法中相对于化疗和新的“靶向”药物的地位的争论中的一个主要因素。然而,人们普遍认为,在国际范围内,数百名患有不可切除LGGs的儿童仍然需要接受放射治疗。
为了减轻这些患者的辐射毒性,一些剂量学和小型回顾性研究表明质子疗法可以减少对发育中的脑组织的低/中等辐射剂量。这项研究为质子治疗后的疾病控制提供了有价值的新数据。
在我们的分析中,我们试图回答3个问题:
1.相对于当代,质子疗法能提供光子治疗技术类似的疾病控制吗?
2.相对于当代光子治疗技术,质子治疗是否引入了独特的假进展或毒性模式?
3.独自于放射疗法,这一大群患者教会了我们什么风险因素和治疗技术?
1.相对于当代光子治疗技术,质子治疗能提供类似的疾病控制吗?
来自美国和欧洲的几乎完全涉及光子疗法的现代研究报告,为期5年无进展生存死亡率在56%到87%之间,总存活率在90%到全切之间。只有1份报告描述了质子治疗后5年的肿瘤控制结果,患者为%3E15。尽管这是一个相对较小的32例患者系列,但结果令人鼓舞,无进展生存率为89.7%,总生存率为全切。我们的174名患者队列显示相似的无进展生存率和总生存率分别为84%和92%。总的来说,在两个机构接受治疗的近200名儿童的结果表明,质子治疗的剂量学精确度与局部失败或“边缘缺失”的风险增加无关。
2.相对于当代光子治疗技术,质子治疗是否引入了独特的毒性或假进展模式?
只有另外一个现代系列进行了前瞻性评估急性毒性儿童低度恶性胶质瘤放射治疗中,涉及三维适形光子治疗;因此,上述研究数据可以作为未来质子和光子治疗研究的有价值的基准。光子研究的调查者报告说,69%的儿童需要5-羟色胺-3受体拮抗剂来治疗恶心和呕吐,而在这个质子系列中,这一比例仅为12.6%。同样,在这个质子队列中,7.4%的患者需要治疗皮质甾类放射治疗后12个月内,相比之下,光子系列中有50%。这些发现与证实接受质子治疗的脑肿瘤成年患者恶心和呕吐相对减少的数据相一致。尽管在过去的十年里,立体定向和强度调制光子放射疗法在儿科LGG得到了广泛的关注和应用,但是没有大规模的系列报道涉及到中等范围的毒性,例如听觉损耗,视力丧失、或内分泌疾病——在治疗的前5年内可能发生在儿童身上。在治疗下丘脑或视通路LGGs时,PTV可能包括处于危险中的器官,例如脑下垂体。在这种情况下,辐射方式与不同的内分泌毒性无关。
然而,对于PTV以外的器官,剂量学数据显示了质子的优势。研究结果从经验上支持了这一结果:只有2例幕上中线以外的肿瘤患者出现了新的内分泌缺陷。这一发现与格林伯格等人报道的质子系列内分泌结果相似。照射后,我们观察到1%的视力退化率和2%的听力丧失率,这两者都优于较小系列的光子治疗后报道的结果。
较近的研究引起了对质子治疗后血管病变和脑干坏死的风险的关注。在接受光子治疗的LGG儿童中,比较数据是有限的。在高危亚群中,临床上的血管病变的发生率可能超过7%,包括患有神经纤维瘤病的儿童或患有下丘脑或视神经胶质瘤的儿童。在90例间脑/视神经通路肿瘤患者中,我们观察到2例(2.2%)有明显的血管病变,尽管随访时间较短,但可能低估了的风险。与血管病变相比,使用光子治疗儿童低级别瘤变(LGG)的脑干坏死的现代比较资料很少。然而,在我们的174例患者中观察到的1.1%的比率很低,并且没有超过公布的光子系列的比率。
有趣的是,一些人推测在质子治疗LGG后假性进展是否更常见。根据不同的定义,光子治疗后,20%至70%的LGG病儿童出现假性进展,常见于患有以下疾病的患者毛细胞星形细胞瘤。曾等人较近发表的较大光子系列描述了放疗后10年29%的假进展累积发生率在毛细胞型星形细胞瘤患者中,发病率为42.9%,类似于我们队列中32.1%的假进展率,在毛细胞型星形细胞瘤患者中同样更高。治疗方法也是相似的:在这两个系列中,68%的患者被观察到,其余的通过暂时性保守手术或皮质类固醇治疗。我们的报告补充了现有的数据,即尽管普遍观察到假进展,但在质子治疗后假进展并不常见。
3.独自于放射疗法,这一大群患者教会了我们什么风险因素和治疗技术?
除了我们对质子治疗的理解外,这个庞大的队列还可以进一步分析患者的危险因素和不同治疗模式下的较佳治疗参数。首先,我们的患者均采用5mm的CTV切缘,比之前大系列报道的10mm切缘小50%。这个小的几何边缘,加上质子治疗精确的剂量学边缘,与局部失败风险的增加没有关系。值得注意的是,我们的结果也表明辐射剂量影响肿瘤控制,其中54 GyRBE可能比低剂量具有优势。虽然在成人中进行了研究,但在儿童LGG人群中,28次剂量反应尚未得到详细的研究,这主要是由于较大的研究中剂量均匀,较小的研究中缺乏统计效力。我们还观察了亚疾病控制患者的脑干和脊髓肿瘤。虽然这些部位可能有生物学上不同的胶质瘤变异,更有可能的是,肿瘤的位置被剂量效应混淆了:脑干或脊髓肿瘤患者不太可能接受54 GyRBE治疗,而这种低剂量可能是较差的结果的原因。这就是治疗的挑战;中线肿瘤和脑干肿瘤似乎都具有较高的毒性风险,因此限制了在PTV中剂量增加到组织的选择。
较近,研究人员提出一线化疗用于儿童低级别胶质瘤可能与视力低下和无进展生存有关。我们的数据并不支持这一发现。尽管如此,我们的数据表明,在治疗的前5年,质子治疗的治疗比例要优于当代化疗方案。如果这一结果在更长时间的随访中得到证实,并且质子治疗变得更加广泛,那么重新检查化疗(和所谓的全身“靶向制剂”)在小儿LGG治疗算法中的作用可能是有必要的。也许有一天,一个5岁的孩子有了新的诊断,在治疗性放疗之前将不需要经历3个(或更多)周期的化疗及其相关毒性,这是研究中13%的患者所采用的策略。
尽管随访时间中位数接近5年,但该系列研究中与晚期效应相关的重要局限性仍不容忽视。正如以前的一份机构报告所证明的,在辐射几十年后,LGG幸存者可观察到严重的毒性。神经认知结果同样需要数年时间来验证质子治疗LGGs的剂量学前景。
结论
研究发现为常见的儿童肿瘤提供了有价值的结果数据,同时也为多方位的病人管理和放射技术提供了有用的信息。质子治疗计划的新兴技术,如那些基于线性能量转移优化传输的技术,可能进一步降低毒性和提高治疗比例。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号