海绵状血管畸形(cavernous malformation,CM)是一种位于脑或脊髓的"桑葚样"病灶,周围有透明质酸化的毛细血管,伴有含铁血黄素沉积物和明确的胶质增生边界,脑干CM可发生于脑干的任何位置。在对脑干CM的自然史研究中,年出血率为2.33%~4.1%,而在手术病例系列研究中,患者的年出血率较高,为2.68%~6.8%[。
脑干CM往往表现为突发的神经功能障碍,可呈波动性的复发—缓解或进行性加重的病程[2]。脑干CM的临床症状与病变的解剖位置密切相关,如动眼神经麻痹主要发生在涉及中脑的病变中,延髓CM通常表现为后组脑神经功能障碍。此外,脑干CM出血也可表现为头痛、头晕或恶心等不典型症状。
许多研究认为,既往有出血史、年龄(<35岁)、病变直径(≥10 mm)、女性等是脑干CM出血的危险因素。
CM可分为散发性和家族性,其中家族性CM占6%,其发生与CCM1、CCM2及CCM3基因的缺失性突变相关,三种基因的突变检出率分别为40%、20%及40%。家族性CM的基因突变检出率为94%,非家族性多发CM基因的突变检出率为67%。
遗传和环境因素在CM的发病机制中均起着至关重要的作用。家族性CM往往会伴随着另一种体细胞突变,也就是同一基因的2个正常拷贝的突变或属于同一功能途径的另一个基因的2次正常拷贝的突变,被称为CM基因突变的"二次打击"。在散发性CM发生的启动过程中,这种"二次打击"的突变形式往往发生于CCM基因中。血管内皮生长因子和炎性细胞因子也可作为导致CM形成的二打击,甚至可改变既有病变的生物学活性,从而导致CM的进展。例如,血管内皮生长因子的过度表达,可导致毛细血管发育不良、内皮细胞增殖、血脑屏障通透性增加,进而导致CM的发生。同时,CM引起的血流动力学改变和静脉高压可导致反复的微出血,进而导致含铁血黄素的沉积,刺激血管生成和CM形成。静脉血管异常也是散发性CM的重要病因。此外,放疗亦可通过诱导血管内皮的增殖和扩张进而增加CM及其出血的发生率。
MRI影像学表现中的"蝌蚪征"、"铁环征"、"光环征"、"桑葚状"或"爆米花状"网状重要等可辅助脑干CM的诊断。三维重建技术和弥散张量纤维束成像可以帮助明确脑干CM与神经纤维丛的位置关系。同时,增强MRI图像上可出现相关的发育性静脉血管异常(developmental venous anomaly,DVA),常表现为"水母头征",从而可以较好通过影像直接明确诊断。
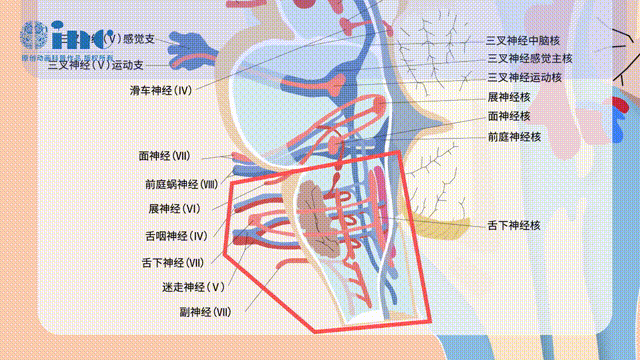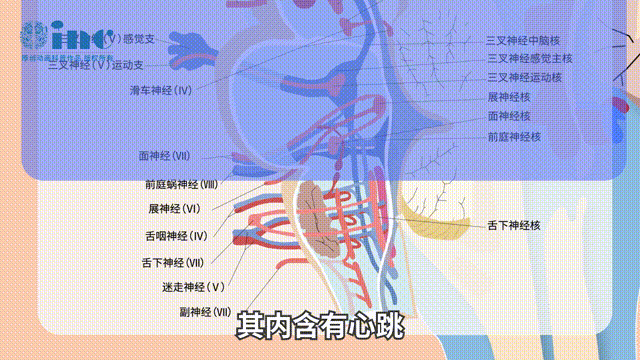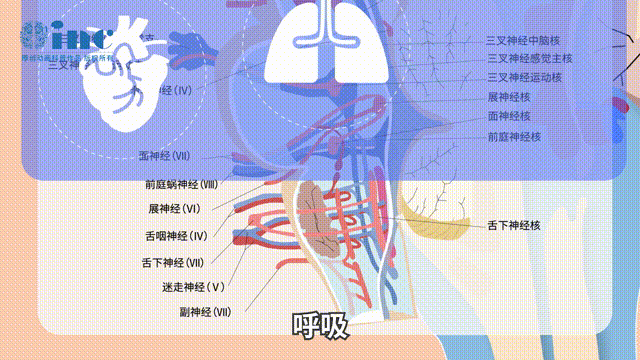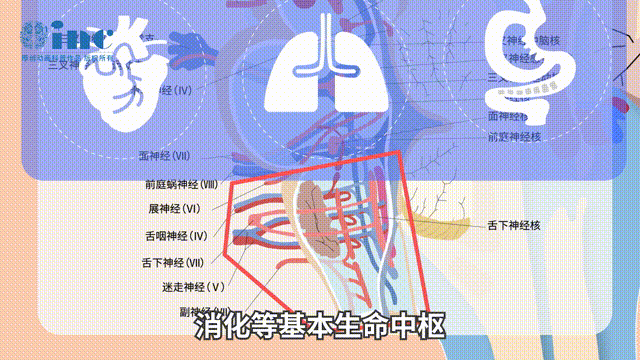
初始出血率及再出血率
不同研究中脑干CM出血率的差异较大。在一项前瞻性研究中,颅内CM的平均年出血率约为2.4%。Gross等认为脑干CM的年出血率为2.33%~4.1%。Cantu等的报道中,颅内CM的年出血率为2.33%。而Abla等和Chen等的研究中提出,脑干CM的年出血率为4.6%和4.7%。出血率的差异可能与入组标准、出血人群的聚集、出血定义的差异以及回忆偏倚等相关;另外,研究样本量小、随访时间短也可能会造成偏倚,影响CM出血率的准确性。在多项前瞻性研究中,招募了未经治疗的无症状CM患者进行保守观察,这些研究本身就存在着选择偏倚,排除了需要治疗且不能忍受后续观察的患者。
此外,并非全部研究都明确定义了出血和再出血。多项报道认为,出血发作是指患者在神经系统检查中存在明确的神经系统症状或体征,并在MRI影像中显示出CM出血或血栓形成。但Stark认为,以临床症状伴随MRI出血表现来定义出血,会导致出血率比真实情况偏低。另外,部分学者仅以影像学定义出血,而部分学者的研究中出血的定义较宽泛(如仅症状改变)。同时,正确判断出血时间才能提高出血率的准确性。部分学者认为脑干CM是先天性病变,也有学者认为脑干CM是后天性病变;若CM是先天性疾病,随着新病灶的出现,患者的出血风险可能会被低估。但是,许多研究由于无法确定病变发生的确切时间且忽略了CM是先天性病变的可能性,从而误判出血率。例如,Aboukais等在比较放射性治疗前后的再出血率时,以CM一次诊断的时间点为实验开始时间,这可能低估了真实的出血率。
在手术病例系列研究中,患者的年出血率可高达2.68%~6.8%。但由于外科手术病例系列研究主要是针对有症状性出血且被咨询至三级医疗中心进行手术治疗的患者,而忽略了无症状出血和不能耐受手术的患者;因此仍可能低估了一般人群中脑干CM患者的实际出血率。
一次出血后,CM再出血的风险会大幅增加。在几项临床研究中,脑干CM再出血的年发生率为32.7%~60%。Barker等的研究结果显示,再出血的风险在初次出血事件后短期内增加,但2~3年后再出血率将由每月2.1%降至0.8%,这种现象被称为"时间聚集"。Arauz等的回顾性研究中发现,采取保守治疗的患者每年再出血率为10%。较近一项针对44例有症状性脑干CM患者的回顾性研究提出,一次症状性出血后临床事件的年发生率为42%。
出血的危险因素
1.深部CM出血风险可能更高:
Porter等认为深部CM(包括脑干病变)每例患者每年的临床事件发生率为10.6%,而表浅病变的每例患者每年的出血率约0%。位于非表浅或深部位置是CM出血的重要危险因素。虽然深部CM(包括脑干CM)与浅表CM在生物学上有相似之处,但是其临床过程往往更具有危险性。这是因为深部CM周围存在着更为密集的神经纤维丛和神经核团等神经组织结构,少量出血即可出现症状,更易被诊断出血,意味着其出血的发现率更高。但是,部分未严格定义出血概念的研究并未报道深部与浅表CM出血率的差异有统计学意义。
2.既往出血史是再出血的危险因素:
研究发现,出血性表现是再出血的危险因素。Flemming等回顾性分析了292例颅内CM患者的临床资料,并随访患者的临床转归及影像学变化;中位随访时间为7.3年,发现既往有出血史是再出血的主要危险因素。2016年,Horne等纳入1620例脑干CM的Meta分析中,有症状和无症状的脑干CM患者的5年再出血率分别为30.8%和8.0%。Mathiesen等的一项回顾性研究中,34例保守治疗的深部CM患者中,23例有症状的CM患者每年出血率为7%,而11例无症状的CM患者的年出血率为2%;此外,无出血临床症状的患者比有出血临床症状者具有更为良性的病程。
3.CM病灶直径、年龄及性别对出血风险的影响:
病灶直径是CM出血的风险因素。但不同研究中报道的病灶直径的界值存在差异,有学者认为病灶直径≥10 mm与出血风险高相关;另一项研究中报道病灶直径≥20 mm是出血的危险因素;亦有研究报道病灶直径>18 mm是再出血的危险因素。同时,CM的出血风险还与患者的年龄相关。Acciarri等发现,儿童(0~18岁)患者的出血率比成年患者更高。另有研究报道年龄<35和年龄>50岁与出血风险较高相关。此外,女性和怀孕也是CM出血的危险因素,可能与雌激素对CM生长和血流的潜在影响有关,但是其具体机制不明。
4.其他导致CM的危险因素:
Li等对331例脑干CM的研究中发现,11例患者在饮酒(5例)或剧烈运动(6例)后12~24 h发生CM出血。导致CM出血的其他因素还包括家族病史和DVA。有研究发现,DVA是CM出血的危险因素,其可增加CM的侵袭性、促进CM的形成。Aoki和Srivatanakul也认为DVA有可能影响CM的形成和临床进程,且DVA与术后再出血相关。此外,多个病灶、病灶周围水肿亦会增加出血的概率,后者导致CM出血的机制包括静脉引流受损、增加病变与周围组织之间的血管连接或病灶侵袭脑干正常组织。Arauz等的回顾性研究中,应用单因素Cox回归模型发现,病灶位于腹侧位置并跨过脑干中线者再出血的风险更高。Denier等对163例家族性CM的研究中发现,CCM3基因突变患者比CCM1和CCM2基因突变患者的出血率更高。
治疗方式及预后
尽管脑干CM少量出血即可导致明显的神经功能症状,但大多数患者在初次出血或再出血后神经功能可恢复至其术前基线水平,甚至完全恢复。虽然伽玛刀治疗可降低再出血率,使患者获得较好的预后,但其放射剂量大,常导致该位置的放射性损伤,从而残留症状、降低了完全恢复的可能性,鉴于伽玛刀手术或保守治疗后2年内CM再出血的风险均可降低,放射治疗的合适性仍存在高度争议。
对于脑干CM患者,应结合患者出血时的临床表现、再出血风险、手术并发症风险以及疾病自然史等因素个体化选择保守治疗、外科手术、放射治疗或药物治疗等措施。尽管手术可能导致较高的并发症发生率,但手术可降低再次出血的风险。为尽可能在切除病灶的同时避免神经、血管的损伤,应充分掌握脑干解剖结构、手术要点,较好寻求有较多成功手术经验的专家治疗。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号