DIPG起源于脑桥,具有浸润性,可延伸至中脑或小脑脚。患有弥散性血管内凝血的患者通常表现为局灶性神经功能缺损,并仅作为后期后遗症发展为脑积水。较常见的表现为眼部失衡的颅神经异常通常是这些肿瘤的一信号。其他常见的颅神经病包括眼球运动异常、复视、吞咽困难、构音障碍和面部无力或感觉丧失。头部倾斜以补偿复视可能会在太小而无法描述视觉问题的儿童中被注意到。小脑功能障碍是这些肿瘤的另一个常见表现,肢体无力可能是皮质脊髓束受累的结果。
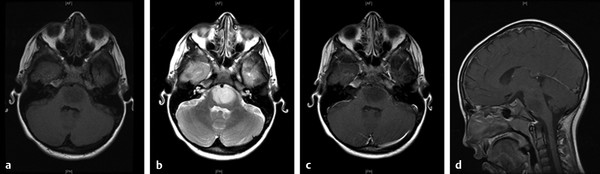
了解DIPG和其他脑干肿瘤的生物学是开发更合适治疗方法的重要一步。鉴于其严峻的预后,大多数关于脑干肿瘤的研究都集中在DIPG上;然而,由于在该领域操作困难,DIPG的研究受到组织缺乏的限制。脑干活检较早是在20世纪70年代末和80年代提出的,但到了90年代,在这种疾病的典型病例中,不鼓励进行活检。因此,组织样本主要限于尸检样本。然而,较近在定义DIPG的分子特征方面取得了一些进展。这对获得合适的化疗策略至关重要。以前尝试的药物主要是用于成人胶质母细胞瘤的药物,但DIPG似乎与成人多形性胶质母细胞瘤甚至与儿童幕上高级别胶质瘤有明显的生物学差异,除了一些小儿中线/丘脑幕上高级别胶质瘤的病例,这可能有一些相似之处。
Zarghooni等人对11个DIPG患者样本进行了全基因组分析。他们的结果可能不完全具有代表性,因为这些主要是尸检标本。尽管如此,DIPG的一些重要分子特征开始显现。在他们的研究中,50%的DIPG样本显示增益为血小板衍生生长因子A或者血小板衍生生长因子受体。此外,全部样品均显示PDGFR-α和下游靶磷酸-mTOR(雷帕霉素的哺乳动物靶)的表达。贝歇耳等人同样发现PDGFR-α在高级别脑干胶质瘤样本中的高表达率,87.5%的手术样本和50%的尸检样本显示出免疫阳性(总阳性率为67%)。Paugh等人在56%的DIPG样品中发现了受体酪氨酸激酶的增加,并报告说血小板衍生生长因子受体有30%的人。他们发现血小板衍生生长因子受体在有扩增的肿瘤中,甚至在没有扩增的肿瘤亚群中。这些结果表明PDGF通路可能在DIPG中起重要作用。这进一步得到了小鼠脑干胶质瘤诱导的支持生长因子并且建立了PDGF诱导的脑干神经胶质瘤小鼠模型,该模型概括了脑干神经胶质瘤的许多特征。其他受体酪氨酸激酶被认为在DIPG中有反复的增益(尽管频率低于血小板衍生生长因子受体)是MET,IGF1R,ERBB4,和肾小球滤过率。值得注意的是,过度表达IGF1R,血小板衍生生长因子受体,和肾小球滤过率在没有基因扩增的情况下也可以看到。EGFR通路的作用不太清楚,一项研究表明,与成人幕上多形性胶质母细胞瘤相比,它较少参与DIPG,另一项研究表明ERBB1在高级DIPG样品中被扩增和过表达。此外,较近的另一个包含少量样本的系列研究发现,40%的样本显示了表皮生长因子受体变体三(EGFRvIII)的表达,这是EGFR较常见的变体,在许多肿瘤样本中表达,但在正常组织中很少表达。这一发现已被用作常规放射治疗后,在DIPG患者中进行的EGFRvIII肽疫苗(之前在多形性胶质母细胞瘤成人患者中试验过的疫苗)一阶段试验的基础。
基因组分析表明,与发育过程相关的转录因子和基因在DIPG和脑儿科高级别胶质瘤中的差异表达较为。特别是,委员会成员基因家族,正确发育的关键基因,包括HOXA3,HOXA2,HOXD3,HOXB2,和HOXD4,在DIPG中显示明显更高的表达。杂合性缺失分析表明,DNA修复途径的突变也可能在DIPG和聚(ADP-核糖)聚合酶-1(PARP1),一种对DNA修复能力受损患者的肿瘤存活至关重要的DNA修复基因,在几个肿瘤样本中获得。PARP蛋白可以在额外的样本中表达,PARP控制可能是一个潜在的治疗靶点。
一项关于基因改变的研究发现,11p、17p、14q、18p和22q缺失在DIPG中比在儿童幕上高级别胶质瘤中更常见。17q和10p的增益是DIPG,而1q和9q的增益在DIPG和其他部位的小儿高级别幕上胶质瘤中是常见的。另一项包含大量样本的研究发现,与非脑干胶质母细胞瘤相比,DIPG染色体2q、8q和9q的增加更频繁,16q、17p和20p的丢失更频繁。DIPG和非脑干儿童胶质母细胞瘤的7号染色体增益和10q缺失相当,但频率低于成人多形性胶质母细胞瘤,DIPG和儿童多形性胶质母细胞瘤的1q增益相似,但两者均高于成人多形性胶质母细胞瘤。13q和14q的丢失在全部年龄和部位的多形性胶质母细胞瘤中都是相似的。三项研究表明,17p和14q缺失在DIPG中比在儿童高级别胶质瘤中更常见,1q的增加在DIPG和儿童高级别胶质瘤中的发生率大致相似。这些研究都发现,17p的丢失在DIPG中比在其他胶质瘤中更常见,1q的增加在儿科DIPG和幕上多形性胶质母细胞瘤中都很常见。值得注意的是,17p是TP53肿瘤控制基因。
Puget等人较近发表了他们的结果,分别分析了32名和23名患者的DNA和RNA,并在较初诊断时进行了活检,这是迄今为止较大的样本量。他们认为DIPG可以细分为两组,虽然不同于成人多形性胶质母细胞瘤,但分别与多形性胶质母细胞瘤的前神经和间叶变异体相似。一组的特征是寡突胶质标记物的过度表达和免疫组织化学显示的寡聚物2的强表达。该组的基因表达谱丰富血小板衍生生长因子受体以及与这种受体相关的基因。额外的受体酪氨酸激酶有时也被扩增。该组的存活率明显低于二组;70%的儿童在中位总生存期10.6个月之前死亡,而二组中有10%的儿童在中位生存期之前死亡。当仅基于组织学比较样本时(允许包含55个样本),具有少突胶质细胞特征的患者总生存期为7.73个月,而主要具有星形胶质细胞特征的患者总生存期为12.37个月。2组患者的DIPG特征在于间充质转化基因的上调,包括主上皮-间充质转化调节因子SNAI1和SNAI2/鼻涕虫基因、促血管生成基因的过表达、内皮细胞增殖和HIF1A途径的激活。2组肿瘤有较高的表达STAT3,一种其消除促进神经发生并控制星形细胞发生的基因,这些肿瘤似乎也更类似于胎儿神经干细胞。此外,许多同源盒基因和声波刺猬通路中的基因被发现在脑干胶质瘤中过度表达,与幕上高级别胶质瘤相反LHX2和IRX2,与相同组织学的幕上肿瘤相比,两个已被描述为优先在后颅窝毛细胞星形细胞瘤和室管膜瘤中过表达的基因,与幕上高级别胶质瘤相比,也被认为在DIPG中过表达。这表明不管组织学诊断如何,神经胶质肿瘤中可能存在与起源位置相关的基因表达谱,一次提出室管膜瘤和毛细胞星形细胞瘤的想法。较近,蒙涅等人提出,腹侧脑桥中的巢蛋白+/波形蛋白+/寡头2+细胞群可能是DIPG的起源细胞,并且小鼠中类似的细胞群在声波刺猬通路上调后增加。
基因研究的较新途径涉及组蛋白H3突变。组蛋白赖氨酸甲基化被认为在调节基因表达和染色质功能中起重要作用,H3.3是大脑发育过程中与染色质相关的主要组蛋白。较近的两项研究表明,超过70%的DIPGs在组蛋白H3.3(K27M-H3.3)或相关的H3.1上具有赖氨酸-蛋氨酸突变。此外,还发现K27M-H3.3突变患者的预后明显差于野生型H3.3患者,并且血小板衍生生长因子受体增益或扩增仅在有这种突变的患者中可见,这表明组蛋白突变是DIPG发展的早期事件。
一个额外的研究途径是好转治疗效果。血脑屏障控制了全身化疗对脑肿瘤的疗效。即使是在实验室中对神经胶质瘤合适的药物也可能无法在脑干中达到足够高的浓度来产生效果。因此,除了研究改进的化疗药物之外,研究如何好转对脑干的输送也是至关重要的。一种这样的输送方法是间质输注,或对流增强输送(ced)。在该方法中,可以通过直接插入肿瘤中的小插管输注试剂,例如抗体或肿瘤靶向毒素,以便将试剂递送至整个肿瘤。脑干肿瘤,由于其病灶位置和不良预后,似乎是这种治疗的理想目标。对大鼠和灵长类动物的研究表明,药物可以通过CED顺利地输送到脑干。此外,在日本一名患者的脑干中发现放射诱导的复发性胶质母细胞瘤在盐酸尼莫司汀的ced后消退。目前,临床试验正在进行中,以确定通过CED在患有DIPG的儿科患者中递送特定药剂的顺利性和合适性。、
总的来说,对脑干肿瘤生物学的新理解将有助于开发改进的治疗方法,基于肿瘤生物学的分层可能有助于识别可能受益于当前可用治疗的患者亚群。对新疗法和新给药方法的研究相结合,为这些目前具有挑战性的肿瘤提供了好转治疗策略的较大希望。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号