AVM=动静脉畸形;bFGF=碱性成纤维细胞生长因子;CM=海绵状畸形;MMP-9=位于20号染色体的基因;SRS=立体定向放射治疗;VEGF=血管内皮生长因子。
海绵状畸形(CMs)是一种血管造影上隐蔽的低流量血管病变,一般人群中发病率约为0.4%-0.8%。家族性CMs可能与CCM和KRIT基因突变相关,导致血管生成。临床未破裂的CMs出血率为每年1%至2%,尽管MRI总是显示畸形中的旧血沉积。在一次临床确认出血后,每年额外出血的风险增加到4%,2次或更多出血后每年可高达34%。当位于可触及的大脑区域时,CMs可以通过显微外科手术切除。然而,位于没有软脑膜或室管膜通道的大脑深部区域的出血性CMs在手术难度高,并与的并发症发生率相关,一些医院会选择立体定向放射外科(SRS)作为此类CMs的治疗选择。
虽然已经报道了SRS后CMs的复发出血率,但相对较少的出版物描述了SRS后CM的组织学反应。现有的研究是病例报告和小病例系列,描述了放射手术后CM组织的闭塞和瘢痕。简单地说,Nyáry等人描述了一例用SRS治疗CM导致CM纤维化的病例。同样,Tu等发现3例SRS后CMs出现玻璃化、胶原形成和部分管腔闭塞;然而,与动静脉畸形(AVMs)相比,CMs的管腔区闭塞程度较低。Gewirtz等人在8例接受SRS治疗的CMs患者中发现了血管通道纤维化、纤维蛋白样坏死和铁蛋白化。这些研究中的组织样本来自SRS或常规照射后的切除。分析切除样本的局限性在于仅评估对SRS不响应的CMs时可能存在偏差。
根据以往的研究,SRS后,8%到17%的患者由于持续的出血事件需要延迟切除。为了更好地了解SRS后CMs反复出血的原因,我们对4例接受延迟显微手术的患者的切除标本进行了组织病理学分析。
研究方法
2001 - 2013年期间,Leksell伽玛刀术后9例CM复发出血(中位数31个月,范围6-57个月)。其中5例患者接受了CMs的后续切除术。显微外科手术切除的一个组织样本很小,不足以进行分析。因此,使用其余4例患者的CMs进行详细的组织病理学分析。SRS与显微手术之间的间隔时间分别为4个月、2.5年、3年和7年(表1)。
研究结果
组织病理学分析显示血管硬化早在SRS后4个月就出现。在SRS后2 - 7年年的样本中,硬化的血管很明显,但也有不完全硬化的血管以及一些新生血管。
说明性案例
本研究分析的4名患者的样本来自SRS后不同时期的切除。这些样本也来自4个不同的解剖位置:右侧丘脑/中脑区、右侧桥脑、左侧内侧颞叶和左侧桥脑。
案例1
病史摘要
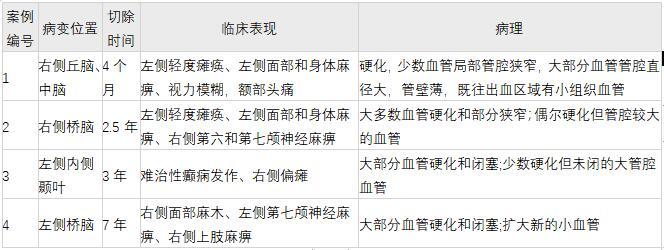
一名23岁女性,急性发作面部和口腔麻木,伴有轻度额部头痛。对她的大脑进行的计算机断层扫描研究显示,2×2厘米的急性右侧丘脑出血延伸至中脑。磁共振成像结果与出血性CM相符。根据病变部位,在讨论不同的选择后,选择观察。患者6个月后出现复视和左侧轻瘫,并在MRI上进一步出血。稳定后出院,2个月后返回接受SRS治疗。
手术及术后过程
患者接受伽玛刀手术:单次治疗中,较大剂量为28.2 Gy,边缘剂量为14 Gy,治疗2.33 cm3畸形。SRS后三个月,患者报告头痛恶化,重复MRI显示新出血。在48小时的治疗过程中,她再次好转,没有神经功能缺陷。一个月后,她经历了另一次急性发作性头痛,并发展为左侧轻瘫,出血量增加至2.6 cm3(图1A)。她接受了右侧颞下开颅显微手术切除CM,并将CM整体切除。术后6个月,她的左轻瘫持续存在,但明显好转。
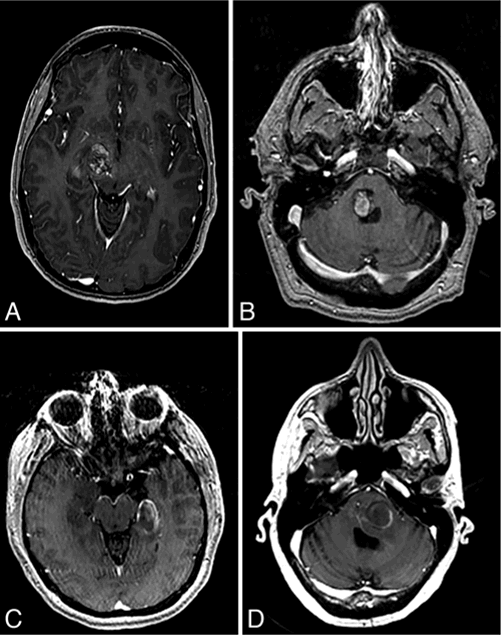
图1:增强t1加权MR图像显示,病例1 (A)右侧丘脑/中脑出血性CM,病例2 (B)右侧脑桥,病例3 (C)左侧颞中叶,病例4 (D)左侧脑桥。
案例2
病史摘要
31岁男性,18个月期间出现2例桥脑出血。出血导致进行性左侧麻痹,右侧外展麻痹,以及弥漫性左侧感觉丧失,包括面部、手臂和腿部。磁共振成像显示脑桥右侧有出血病灶(图1B)。
手术及术后疗程
进行了立体定向放射手术:较大剂量30-Gy,边缘剂量15-Gy,体积为2.8cm³。SRS术后两年半,患者复视恶化,右侧面神经麻痹。磁共振成像显示脑桥CM复发和进行性出血性扩大。他接受了枕下颅骨切除术和次全切除CM。
组织学和免疫组织化学
SRS前立体定向活检标本的H和E检查和三色染色显示CM特征的背对背扩张血管(图3A)。SRS 2.5年后切除CM组织显示不完全血管硬化和管腔狭窄(图3B)。血管内皮生长因子染色较弱,可能是烧灼伪影所致。MMP-9染色巨噬细胞,在小血管附近呈弥漫性染色,而bFGF阴性。
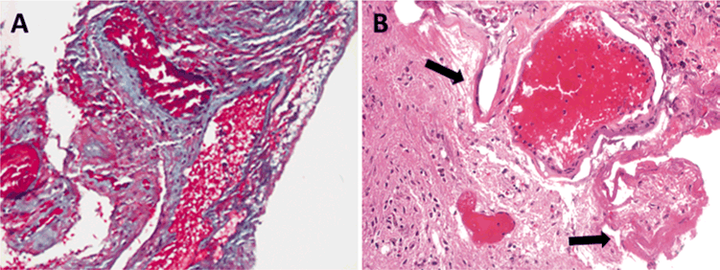
图3:A:立体定向穿刺活检CM组织三色染色显示与CM一致的背对背薄壁血管。原来放大×200。B: SRS后两年半,切除的组织显示一些血管不完全硬化(箭头),尽管许多是部分或完全硬化。H & E,原创放大×100。
案例3
病史摘要:
16岁癫痫女性患者行左侧近中颞叶CM部分切除术(图1C)。9年后,当她25岁时,她出现了进行性右侧无力和无法控制的部分癫痫发作。
手术及术后疗程
剩余CM采用伽玛刀手术治疗:较大剂量为30-Gy,边缘剂量为15-Gy,体积为1cm³。三年后,癫痫发作的频率再次增加,她接受了一次翼点开颅手术。术后意识模糊和右侧无力在5天内逐渐消失。手术一年后,在抗癫痫药物治疗期间,她的癫痫发作频率降低了。
组织学和免疫组织化学
SRS术后3年切除CM的H & E和三色染色显示许多硬化血管,有时伴有小血管数量的增加(图4A)。血管中VEGF的免疫染色较轻(图4B),但组织也显示严重的烧灼伪影。残留未闭血管附近的红细胞提示畸形中存在持续的微出血,尽管MRI没有间歇性出血的证据。血管附近有mmp -9染色的巨噬细胞和VEGF弥漫性染色,但bFGF阴性。
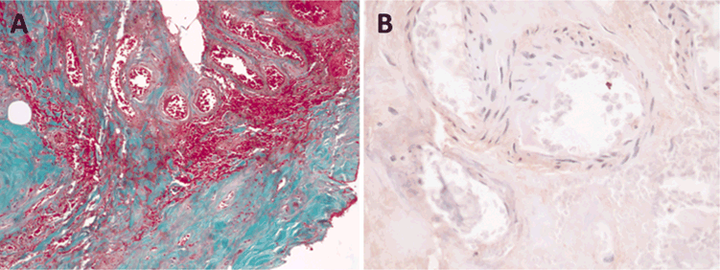
图4:A:三色染色显示大部分血管壁硬化,但有一个区域存在小血管。原来放大×100。B:虽然形态学提示新生血管,但VEGF染色较浅,可能是烧灼伪影所致。原来放大×400。
案例4
病史摘要:
女性,51岁,面部麻木,头晕,视力模糊1周。CT扫描显示左桥脑出血。再次MRI显示进一步出血。
手术及术后疗程
病人接受了枕下开颅术的血栓清除。由于术后影像学显示CM残留,4个月后她接受了伽玛刀手术:较大剂量为28-Gy,边缘剂量为14-Gy,体积为0.65cm³。直到7年后,她出现了新的左侧面部下垂和右侧面部麻木。影像学研究显示新的出血延伸至四脑室(图1D中未显示)。她行枕下开颅术并切除整个CM。
组织学和免疫组织化学
H & E染色切片显示明显的血管硬化,伴有纤维蛋白样坏死和玻璃样变(图5A和C)。三色染色显示大部分血管完全硬化,但局部可见扩张的薄壁血管,有少量硬化(图5B), VEGF染色牢固(图5D)。
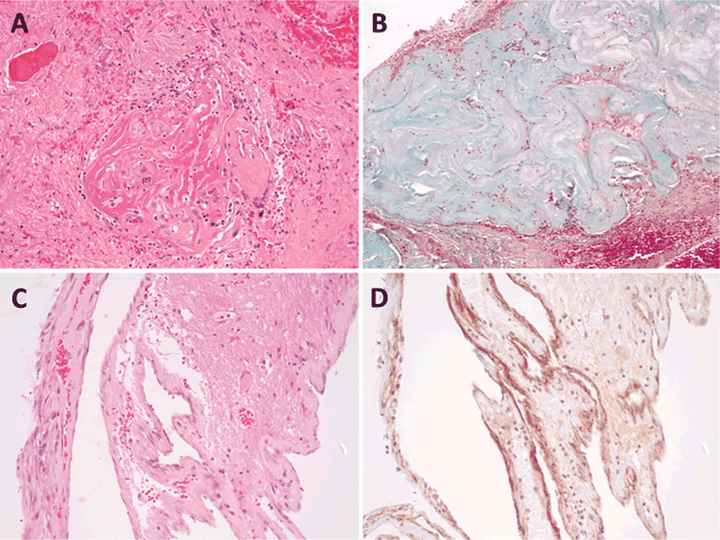
图5:SRS之后7年。血管硬化常见,三色染色可见透明质化(A)和血管腔完全闭塞(B);然而,薄壁血管在一个区域突出(C),这些血管的VEGF染色强烈(D)。原始放大×200 (A)和×100 (B-D)。
CMs中SRS的基本原理
以前的研究表明,在SRS之后,反复出血性CMs的额外出血风险从每年高达50%下降到较初2年的8%-10%,之后下降到1%-1.4%。尽管Karlsson等人仍然对SRS的较终出血风险保护持怀疑态度,但他们注意到SRS后4年出血率呈下降趋势。他们还指出,较高的放射手术剂量可降低治疗后出血的风险。出血风险年的缓慢降低表明SRS消除需要数年时间。在这个潜伏期期间,CM患者可能会反复出血。由于大多数CM患者都经历了SRS的深层畸形,反复出血,因此相对较少的组织学研究报道也就不足为奇了。为了进一步了解SRS复发性出血的潜在原因,我们研究了4例因反复出血而需要切除CM的患者的组织学发现。
血管畸形血管的组织学反应
由于内皮细胞增殖,腔内肌成纤维细胞的形成,以及治疗后血管壁的透明化和硬化,对AVMs的立体定向放疗可导致进行性腔内血栓形成。然而,详细描述SRS后CMs的组织病理学分析的报道很少。一些研究的作者声称,使用SRS治疗的CMs与使用SRS治疗的AVMs有一些相似之处。Nyáry等人在SRS后1年显示AVMs和CMs的血管阻塞以及间质组织的纤维化。Tu等发现AVMs和CMs均存在蛋白溶栓和透明状血管壁;然而,SRS术后AVMs几乎完全或完全闭塞,而CMs部分闭塞有差异。照射后海绵状畸形通常表现为纤维蛋白样坏死,但血管通道未闭。
早在SRS术后4个月,我们就检测到部分血管闭塞和血管壁硬化。然而,正如我们所怀疑的那样,SRS后不久,大多数血管没有硬化。这种未闭血管容易出血,直到发生进一步的硬化和闭塞。与这一发现一致的是,正如我们之前的研究所证明的,在SRS后的前2年有较高的出血风险。在SRS后2.5年和3年接受手术的患者的组织学样本中发现闭塞的血管更常见。然而,即使在这些时间点,也有许多血管壁硬化但管腔开放的大血管。缺乏广泛的血管闭塞表明患者仍然有从这些大血管出血的危险。这一发现与我们之前的分析一致,即在头两年每年再出血的风险为8.8%,之后下降到1.1%。
在本研究中,SRS术后7年,大部分血管完全闭塞。立体定向放射手术可导致CM血管壁玻璃化,但这些改变在直径与毛细血管和小静脉相同的CM小血管中未见。考虑到CMs通过新血管生成增殖,我们假设在原始辐射(SRS)暴露后出现了小直径新生血管。这种较初的新生血管可能发展成为典型CMs中所见的更典型的薄壁大管腔血管。尽管放疗在改变血管形态方面具有早期效果,但新生血管以及薄壁血管的持续扩大应被认为是可能的再出血机制,即使在放疗术后7年。
在SRS后肉芽组织或较大的血管中通常可以发现突出的内皮细胞,类似于未辐照CM中报道的组织血栓和新生血管。内皮细胞参与辐照后血管新生的研究已经在异种肿瘤模型和缺血损伤模型中进行过。来自骨髓的循环内皮祖细胞已被证明在新生血管区域定居并分化为内皮细胞。尽管肿瘤和CM对辐射的反应可能不同,这些研究表明内皮细胞的可能来源是邻近或循环的祖细胞。随着内皮细胞祖细胞的新招募,新生血管可能产生容易出血的新血管。
本研究的一个局限是样本数量少。在9例复发性出血患者中,只有5例被认为适合切除(1例因组织样本不足而被排除在分析之外)。少数病例可能提供选择偏差,因为它们是更严重的出血,导致医学上难以解决的症状。此外,CM发展的时间表也不充分,因为只发现了4个月和2.5、3和7年的样本。此外,这些样本来自大脑的不同区域。然而,本研究通过对不同切片的分析以及对新生血管标记物的免疫染色,得出了SRS作用的谨慎结论。
研究结论
在这项研究中,全部4例SRS后CM患者的血管都不完全硬化,这表明可能是再出血的原因。在3例患者中,有怀疑新生血管的血管变化,这表明这种变化也可能在某些再出血病例中起作用。SRS可能导致血管硬化,但基质成分继续产生促进新生血管形成的血管生成因子。然而,本研究中的病例数量太少,无法确定,需要进一步研究更多的病例。
那么脑海绵状血管瘤究竟该如何治疗?
基于循证证据的管理指南
尽管有许多关于海绵状血管瘤(CAs)的文章,但是关于较佳的诊断和管理策略的争论则仍然存在。作为在美国的主要的病人支持组织,血管瘤联盟 (Angioma Alliance)倡议代表病人对海绵状血管瘤(CA)进行研究,组建由临床医生参与的多学科写作小组,帮助总结有关海绵状血管瘤临床医护的现有文献,关注五项主题:1)流行病学和自然病史,2)基因检测和咨询,3)诊断标准和放射影像学标准,4)神经外科考虑因素,5)神经系统方面的考虑。写作小组中的参与者根据事先设定的协议,回顾文献,评估证据,提出建议,达成共识,争议辨论,和寻找知识缺口。对(从1983年1月1日至2014年9月31日)的1270篇文章,他们基于方法标准选择98篇,并确定了另外38篇近期或相关的文章。这些文章按主题编辑以总结当前关于海绵状血管瘤的知识,根据美国心脏协会/美国卒中协会标准按(效果大小)分类并按(确定性估计)分级,制定出对23项管理建议。指南经过同行评审,并于2017年出版,较为详细的内容可网上阅读(www.angioma.org/ccmguidelines)。因为没有可用的随机对照试验的报告,没有A级的;然而,11(48%)项为B级,12项(52%)为C级。写作小组的建议中,I级的8项(35%),II级10项(43%)和III级5项(22%)。一般低水平的建议和分级,需要进一步的研究以更好地指导临床实践。
手术的机会与挑战
较近编纂的基于循证证据的海绵状血管瘤的指南提醒尚无比较切除手术和保守治疗的随机对照试验的报告,而且大多数病例研究对系统评价的贡献存在大量偏倚和缺乏裁定性结果。一项基于人口的研究显示手术或开始接受药物/保守治疗后5年的预后较差,相比接受药物治疗的海绵状血管瘤患者,接受手术治疗的海绵状血管瘤患者出现症状性出血和局灶性神经系统障碍的风险更高。然而,这项研究并不是随机的,很明显,接受手术治疗的病人病情较重,手术前海绵状血管瘤更有可能经历过出血。然而,海绵状血管瘤通过手术获益不能被认为是理所应当的,重要的是要权衡手术风险与在特定的临床场景和病变部位的海绵状血管瘤的自然病史。
病例研究报告的幕上海绵状血管瘤的外科手术致死致残率普遍较低,但是脑干病变手术切除的致死致残率较高。无论手术并发症率多么低,都明显超过了从未出血的病变中的出血带来的低风险。因此手术切除无症状的病变,特别是那些处于深部或脑干位置几乎从未被证明是合乎情理的。然而,相比海绵状血管瘤出血后复发性颅内出血的风险,同样的风险更为有利。取决于海绵状血管瘤的位置,切除手术的风险会有很大的不同,这应在制定手术决定时加以考虑。因此,对症状性的,易接近的海绵状血管瘤,由于一次出血后再次出现的风险增加,而与手术相关的并发症发生率较低,一般建议手术切除。
位于岛叶、基底神经节或丘脑等深部的海绵状血管瘤,涉及包括深部核团和白质传导束,并有损伤小的穿通动脉风险的关键结构,需要一个更具技术挑战性的手术。对于有经验的团队,与这些海绵状血管瘤相关的术后并发症发生率为5%-18%,死亡率接近2%;但许多病人较终从严重残疾中康复。在近一半病例中,手术切除脑干海绵状血管瘤与更大的早期并发症发生率有关,但多数患者也会随着时间的推移而抗复。颅底手术入路可促进脑干病变的切除。据信,当在重要功能区域使用如图像引导、神经电生理监测,和激光辅助技术等技术辅助手段,能好转切除策略的效果;然而,只有有限的对照研究支持特定模式。复发性出血,以及在深部重要功能区位置和脑干的手术可导致严重残疾,相对于先前的功能状态,引发了关于时机以及决定手术的临界值的争议。脑干病变手术的直接后果更容易在遭受不止一次出血或先前出血后更大的残疾的患者中得到证明。脊柱海绵状血管瘤(CAs)也面临类似的挑战,大多数报告都记录了类似的脑干的结果,支持类似的治疗决定。
由于海绵状血管瘤可以顺利地通过显微外科手术切除海绵状血管瘤,从而控制药物难治性癫痫发作。
如果病变是单个的,并且与癫痫发作症状相关,且可电生理定位。在患者术前癫痫发作的持续时间长且为多处病变的患者,使用病灶切除术,控制癫痫发作的机会较低。有一个很好的论点针对单发病灶患者的早期手术治疗以及较近出现的病变定位性癫痫,因为这些病人可以获得一种没有癫痫发作、没有损伤、在很多情况下,无需抗惊厥药物的生活。患有长期顽固性癫痫发作的患者,可能病变周围含铁血黄素被顺利切除,并且在颞叶癫痫患者中切除邻近的中颞结构,则控制癫痫发作的可能性更大,与记忆功能障碍或海马萎缩相关。较近的报告显示,海绵状血管瘤激光纤维消融的作用具有治疗相关癫痫的潜在的应用前景。
关于切除与静脉发育异常(DVA)相关的海绵状血管瘤的数据存在矛盾,大多数作者提倡保留静脉发育异常(DVA),以防止脑水肿、出血和/或静脉梗塞等严重并发症。总之,只有在静脉发育异常(DVA)小的情况下,或者只有在其引流的脑组织也被切除的情况下,才能切除静脉发育异常(DVA),(就像在少见的病例中因局部静脉畸形和癫痫发作行脑叶切除术)(as in rare cases of modified lobectomies for regional venous dysmorphism and seizures)。
立体定向放射外科(SRS)被认为是位于重要功能区的症状性海绵状血管瘤的另一种治疗方法,大多数研究确定SRS治疗后2年以上出血发生率下降。然而,不能推断出因果关系,大多数自然病程的研究也显示出血2年后的再出血发生率的下降。较近,作者主持了一项对比治疗一开始脑干出血的患者与治疗二次出血的患者的回顾性研究;作者发现没有两组之间的年出血率没有差异。对儿童和家族性患者辐射暴露是否存在会促进发生新的海绵状血管瘤抱有合理的关切。SRS治疗的并发症并非微不足道,是手术切除被认为有的在重要功能区的病变,而且减少出血的较佳的SRS治疗剂量尚不清楚。
以下是基于现有证据提出的有关海绵状血管瘤手术的共识建议,使用Delphi技术进行后续审核(按照美国心脏协会标准列出循证证据的分类和分级):
1. 无症状的海绵状血管瘤患者不建议手术切除,特别是位于重要功能区的,深部的,脑干或脊柱位置,多个无症状的病变也不建议手术切除(III类,B级)。
2. 因为心理负担,昂贵和耗时的随访、促进生活方式或职业决定,或可能需要抗凝治疗的患者,如果是在非重要功能区的容易接近的孤立的无症状的海绵状血管瘤,可考虑手术切除,以预防未来的出血(IIb类,C级)。
3.在致痫性病灶没有不确定的情况下,应考虑早期手术切除引起癫痫,是药物难治性癫痫,的海绵状血管瘤(IIa类,B级)。
4. 对症状性容易接近的海绵状血管瘤病变可以考虑手术切除,致死致残率与伴随病变生存2年左右相当(IIb类,B级)
5. 如果是症状性的或既往出血后,深部海绵状血管瘤病变可考虑手术切除,致死致残率与伴随病变生存5-10年相当(IIb类,B级)。
6. 在回顾术后早期的致死致残率的,以及对生活质量的影响后,在二次症状性出血后,提供脑干海绵状血管瘤的完全手术切除是合理的,因为这类病变具有更强的进袭性(aggressive)病程(IIb类,B级)。
7. 单次致残性出血后,或脊柱海绵状血管瘤,手术切除脑干海绵状血管瘤的适应证较弱(IIb类,C级)。
8. 有既往症状性出血的单独的海绵状血管瘤病变,如病灶位于重要功能区,手术风险高得令人无法接受,可考虑放射外科治疗(IIb类,B级)。
9. 手术可接近的、无症状的海绵状血管瘤,以及担心发生新生病变的家族性海绵状血管瘤疾病,不建议接受放射外科治疗(III类,C级)。
(经血管瘤联盟批准修改,源自Akers A, et al: Neurosurgery 80:665–680, 2017。)
结论
总之,脑海绵状血管瘤的治疗通常更倾向于神经外科手术。
参考资料:
1、DOI link:https://doi.org/10.3171/2014.10.JNS14499
2、doi:10.3171/2019.3.JNS181724

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤



 沪公网安备31010902002694号
沪公网安备31010902002694号