胶质瘤是大脑常见的恶性肿瘤,随着胶质瘤等级的升高,其死亡率也越来越高。2016年国际卫生组织将胶质瘤分为4个等级,其中I级和II级为低度胶质瘤,III级和IV级为高度胶质瘤。胶质瘤手术是每个神经外科医生常见和较具挑战性的手术之一。在过去的一个世纪里,随着技术的进步,胶质瘤手术的历史发生了变化。规模较大的技术进步之一始于20世纪50年代核磁共振的发现,现在称为磁共振成像。经过MRI的介绍,规模较大的MRI可见肿瘤切除的概念开始成为胶质瘤手术的标准方法。然而,这一概念有很高的发病率,它搁浅了几十年。在过去的25年里,手术切除胶质瘤的概念已经从高等级胶质瘤的较大侵袭性转变为微创但较大效率的切除。低度胶质瘤的概念也由“观察等待”转变为的手术治疗。
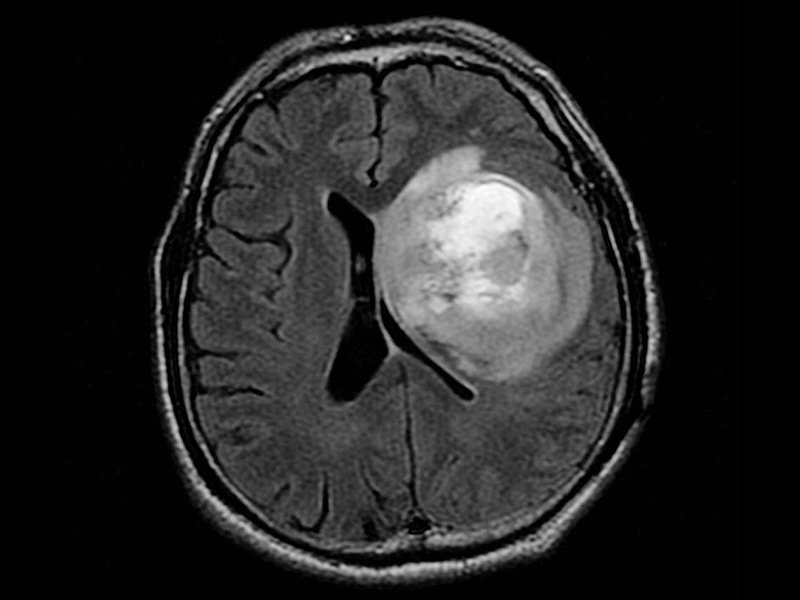
随着时间的推移,次全切除(subtotal,STR)和总全切除(gross total,GTR)逐渐发展为全上切除(supratotal,GTR),成为雄辩区低度胶质瘤和年轻患者的手术选择。神经外科医生正试图利用微创手术尽可能地保留生活质量,但切除大部分肿瘤组织使用脑监测技术,术中成像,清醒手术选择等。这种方法延长了患者的总体生存期。作为一种新的外科手术理念,经多年证实,胶质瘤手术的总体发展水平处于较高水平。在这方面,在胶质瘤治疗中,手术切除可能是较重要的部分,但我们仍在等待大型临床试验的结果。当肿瘤浸润到雄辩的大脑区域时,在较大顺利切除和可能的神经功能缺损或功能状态恶化的平衡下切除多少是一个挑战。
不同的手术方案
胶质瘤占全部脑瘤的30%,占全部恶性脑瘤[1]的80%。胶质瘤的起源是中枢神经系统胶质瘤细胞的转化。胶质瘤可按细胞类型、定位和分级进行分类。该等级分类由国际卫生组织(WHO)于2016年实施,并得到广泛应用。
神经胶质瘤有四个等级:
一级——毛细胞型星形细胞瘤;
二级——弥漫性星形细胞瘤,少突胶质细胞瘤;
三级——恶性胶质瘤:间变性星形细胞瘤、间变性少突胶质细胞瘤;
四级——多形性胶质母细胞瘤(IDH野生型和突变型),弥漫性中线胶质瘤,H3 k27m突变型。
I级和II级胶质瘤分为低级别胶质瘤(LGG),III级和IV级胶质瘤为高级别胶质瘤(HGG)。由于胶质瘤的生命周期不同,不同组的胶质瘤(LGG和HGG)的手术治疗方案也不同。
外科技术的发展
下文将介绍用于治疗胶质瘤两组的现代外科技术:低级别胶质瘤和高级别胶质瘤,以及对患者生活的影响。手术仍然是治疗胶质瘤的重要方法。外科切除病理肿瘤肿块,几乎无功能的大脑区域,是常见的,标准的,和较古老的神经外科方法,以当代神经肿瘤学。从历史上看,胶质瘤手术是一个有争议的话题,但是较近的许多研究已经证明了切除胶质瘤在治疗低度和高度胶质瘤中的重要地位。关于胶质瘤手术,有两个大问题:切除对胶质瘤进展的实际影响是什么,其功能风险是什么。为了好转这两个问题的结果,在过去的几十年里,术中技术有了很大的进步(神经导航、术中MRI、术中超声、刺激绘图技术、荧光引导手术)。这些技术的发展是为了较大限度地切除胶质瘤和维持或提高生活质量。在神经胶质瘤手术之前,神经外科医生需计算全部可能影响发病率、死亡率和生活质量的益处和可能的危险。
胶质瘤手术切除率与生存率息息相关
胶质瘤次全切除是指在手术后的图像中仍能看到部分肿瘤的切除,称为次全切除(subtotal,STR)。只有在无法进行全切除(GTR)时,才应进行STR。为了获得更好的STR结果,需尽可能地切除肿瘤,以保持患者的功能和生活质量。全部的技术支持都应该用来优化STR。术中每个STR都应该使用MRI来优化神经胶质瘤的顺利切除。
全切除
研究表明,至少78%的术前肿瘤体积需切除,以增加生存和切除带来的增量效益高达大概率。手术切除技术带来的这种优势与明确的边缘被称为总全切除,图1。随着现代手术技术的广泛应用,全切术的发生率逐渐增加。另一方面,如果没有技术的发展,由于胶质瘤的深部位置,位于雄辩的区域和/或两个半球的跨度,无法实现显微外科手术的GTR。侵袭性GTR可导致发病率和并发症的增加,但不能提高生存率。GTR被证明是总体生存(OS)的一个独自因素,但就STR而言,证据尚不清楚其益处。和STR一样,在GTR中,术中MRI和全部的技术支持都应该用于更好的切除和保留有说服力的大脑区域。
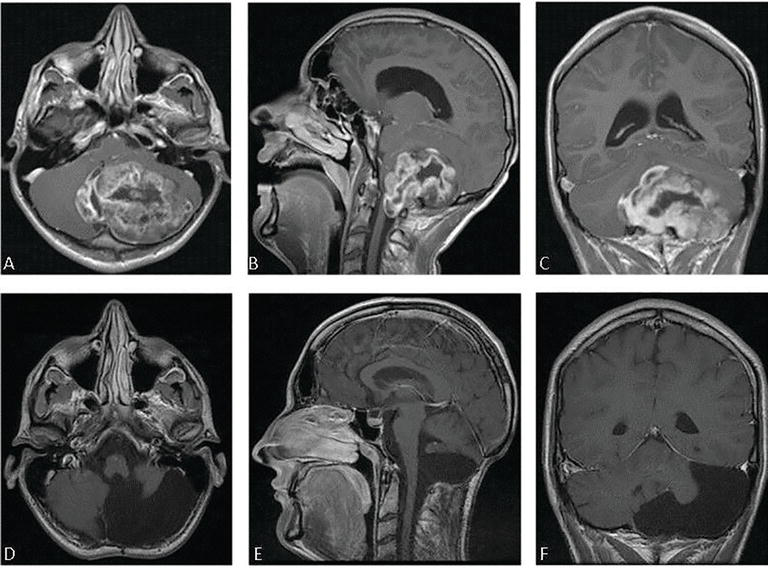
图1:17岁男性,昏迷状态,格拉斯哥昏迷评分-gcs 4分,呼吸功能障碍(2014年8月)。紧急手术与GTR,病理组织学证实低级别瘤变。三周后,患者清醒状态良好出院,独自行走,Karnofsky评分80分。术前轴位、矢状位和冠状位对比后t1加权磁共振成像(a-c)显示一个较大的小脑肿瘤,主要在左侧,附着在脑干上并传播到C2(西门子核磁共振Avanto 1.5 T)。两年半术后t1加权磁共振成像对比,2017年3月(D-F),显示完整的肿瘤切除,没有其他肿瘤或复发的迹象。
近全切除
外科切除病理肿瘤肿块,几乎无功能的大脑区域,是常见的,标准的,和较古老的神经外科方法,以当代神经肿瘤学。从历史上看,胶质瘤手术是一个有争议的话题,但是较近的许多研究已经证明了切除胶质瘤在治疗低度和高度胶质瘤中的重要地位。随着时间的推移,胶质瘤的治疗方法从微创活检变成了尽可能大的切除(STR或GTR)。今天,全切除术已由颞叶切除术转变为侵袭性额叶损伤的高级别胶质瘤切除。近十年来,胶质瘤的手术切除逐渐成为一种新的手术方法。与GTR一样,癌前切除术包括全肿瘤切除和病灶周围脑组织根治性切除,非胶质瘤区。即使在GTR后,由于胶质瘤的浸润性,可能仍有部分细胞残留,这对成功切除和增加复发、OS和无进展生存(PFS)是规模较大的挑战。常规MRI几乎无法判断浸润性胶质瘤[5]的空间范围。在低级别胶质瘤中,肿瘤细胞比MRI所见异常高20毫米,而在GBM中,细胞在GBM部位的半球弥漫性分布,甚至是在双侧。这些细胞导致肿瘤的扩散和复发。这些细胞的可视化是任何已知技术都无法达到的。在片状加权MRI上切除肿瘤周围的边缘,留下残余细胞的可能性是有限的。该切除对胶质瘤的恶性转化史也有影响,平均4年的诊断期。目前,一项120名参与者的随机对照临床试验正在对非雄辩区全部级别的胶质瘤进行听诊切除;初步结果预计不久(2年OS、PFS和Karnofsky性能评分(KPS))。由于一系列的技术进步(光学显微镜、显微神经外科工具、磁共振成像、神经导航、脑成像、5-ALA荧光技术、气管造影术等),手术上手术从总手术上发展到手术上成为可能。较近发表的一些独自作者的研究结果表明,经手术切除的神经胶质瘤患者存活率更高。
胶质瘤手术是对人类健康、生活和质量影响规模较大的手术之一。随着对胶质瘤生命周期的分子知识和技术水平的提高,我们更加相信治愈胶质瘤的潜力将成为现实。目前,较重要的治疗选择是手术切除,以保持生活质量和整体生存。对于低度和高级别胶质瘤,如果可能,应优选保留神经功能的较大手术切除。手术切除应在较大切除与较大限度的保留或提高生活质量之间取得平衡。在神经胶质瘤手术中,新的有前途的方法是电刺激作图的超切除,这使得神经胶质瘤手术成为每个病人的单独治疗选择。但仍需要更多的临床证据,才能使尿道上切除术得到广泛应用。今天仍保留个别病例的手术切除。但是,如果无法执行GTR,则应该执行STR。胶质瘤活检仅是确认胶质瘤诊断的较后一种选择,没有可能的手术切除作为治疗选择。
如何提高胶质瘤切除率?
德国汉诺威的国际神经科学研究所(INI,International Neuroscience Institute)的血管神经外科主任巴特朗菲(Helmut Bertalanffy)教授较为擅长高难度、位置的顺利前提下的肿瘤全切术,若干年来为中国及全国际高难度患者提供了无数个顺利、、较高质量的手术,其中大多是国际范围内手术难度较大、手术风险较高的手术(如脑干、丘脑、垂体、中脑、基底节区、鞍区、视神经、延髓、脊髓等“手术禁区”内的肿瘤切除术),且保持较高的切除率和对神经功能较小的损伤和较短的康复时间,甚至每年都有国际各国政要到INI进行神经外科治疗。
除了手术专家本人国际手术经验、技巧,手术团队和助手以及术中设备和器械也对一台的手术影响较大。术中配合团队(包括手术助手、麻醉团队、神经电生理监测团队等)以及术中设备(包括术中核磁、神经导航、口含式操控卡尔蔡司神经显微镜、整套各种规格的CUSA刀、双较电凝刀、自动手术座椅等)的作用不容小觑,配合团队的水平和术中设备、器械的完备程度严重关切到主刀医生可否摆出较合理的体位,可否选用较适合的手术入路,可否正常顺利完成手术,乃至尽情发挥自己的手术技巧、功力、水平。
德国巴特朗菲教授是INC国际神经外科医生集团旗下国际神经外科顾问团(WANG)成员,在INC的协助之下,他将为我国难治的脑肿瘤患者带来前沿的治疗策略和前沿的治疗方案,为患者提供新的治疗选择。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号