一家姐妹俩居然先后查出了同一种“脑瘤”,又同时咨询了巴教授。评估结果却迥异:一个需要手术,一个仅需观察。这个听起来令人匪夷所思的事情,却真实发生。一对亲姐妹,相差3岁。姐姐查出左侧侧脑室前角旁白质区海绵状血管瘤,妹妹查出桥脑多发结节状信号,考虑桥脑多发海绵状血管瘤。
姐姐的影像
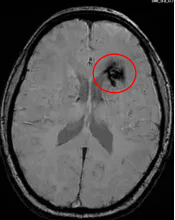
妹妹的影像
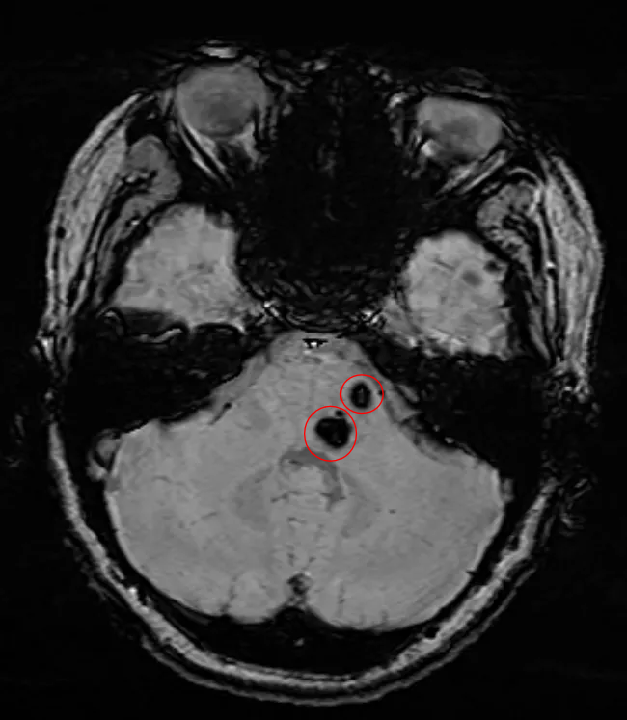
而妹妹已经经历4次出血,出现头部不适、右下肢灼烧感、左侧眼角、嘴角和舌轻微麻木等症状。对于这种情况,INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员巴特朗菲教授建议:为避免将来进一步出血和潜在的临床症状恶化,择期手术可以通过切除病灶中的活动性部分来消除进一步出血的风险。而姐姐的病灶,巴教授给出完全相反的评估:由于不是一个活跃的海绵状血管瘤,甚至还未完全形成海绵状血管瘤,因此目前不需要任何治疗,只需要观察。
那么,脑海绵状血管瘤到底会不会遗传呢?遗传的几率有多大呢?
我们再看这个案例,当基思·诺顿和16岁女儿爱默生同时被确诊家族性脑海绵状血管瘤时,这个家庭陷入了三代人的遗传噩梦。基思的母亲早在1990年代就因脑动静脉畸形(AVM)接受过手术——这种同样会引发脑动脉静脉异常缠结的疾病。面对双重遗传风险,诺顿夫妇立即安排两个大女儿进行预防性MRI筛查(结果均为阴性),而年幼的小女儿还需等待合适检测时机。
“我们就像在和时间赛跑,”基思回忆道。随着病情发展,父女俩随时面临脑出血致残甚至死亡的危险。2018年10月,转机降临:基思突发脑出血被紧急送往巴罗神经科学中心,同日爱默生也出现典型剧烈头痛。主刀INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员Michael T. Lawton(罗顿)教授指出:"临床上仅15%-20%的脑海绵状血管瘤属于遗传型,像这样父女同患的案例更为罕见。"在精密手术规划下,Lawton教授于2019年先后为爱默生(左颞叶)和基思(高危脑干区)成功切除血管瘤。
脑海绵状血管瘤会遗传吗?INC巴教授研究分享
世界神经外科联合会(WFNS)教育与技术委员会前主席Helmut Bertalanffy(巴特朗菲)教授在论文《CCM1 gene deletion identified by MLPA in cerebral cavernous malformation》中提到:
家族性脑海绵状血管畸形(CCM)的发病率为1/2000.可能引发反复头痛、癫痫发作和出血性卒中。基于外显子扫描的方法已鉴定出约70%家族性CCM患者存在CCM1、CCM2和CCM3三个基因的编码区突变,但迄今仅报道过两例CCM2大片段缺失和一例CCM3大片段缺失。
该研究除对三个CCM基因进行直接测序外,还采用新开发的多重连接探针扩增基因剂量分析(MLPA)技术检测基因组缺失/重复。先证者5岁时即因多发性CCM引发强直-阵挛发作伴Todd麻痹及头痛,但直接测序未检出突变。MLPA分析则在该德国CCM家系中检测到跨越CCM1整个编码区的大片段缺失,该结果通过CCM1基因内单核苷酸多态性(SNP)分析得到验证。本研究首次报道CCM1基因缺失病例,不仅证实CCM1基因功能缺失的致病机制,更证明MLPA技术可显著提高CCM突变检出率,这对高风险亲属的预测性检测具有关键意义。

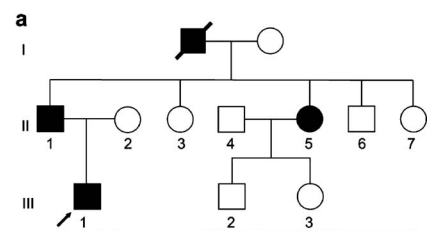
a. 德国家族性脑海绵状血管畸形(CCM)家系图(黑色圆圈=患病女性,黑色方框=患病男性)。
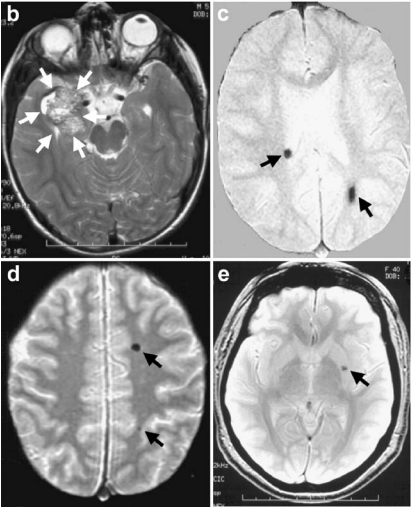
b. 轴位T2加权磁共振成像(MRI)显示先证者(家系图中箭头所指)右侧颞叶内侧大型海绵状血管畸形(白色箭头),该病灶在显微手术切除前被检出。
c. 梯度回波MRI于双侧大脑半球发现多发性无症状海绵状血管畸形(黑色箭头)。
d. 患儿父亲的轴位梯度回波MRI显示左额叶及顶叶两处小型无症状海绵状血管畸形(箭头)。
e. 家系中一位姑姑(II-5)同样在左侧基底节区检出无症状海绵状血管畸形(箭头)。
脑海绵状血管瘤可为散发性,也可为家族性
家族性脑海绵状血管瘤
家族性脑海绵状血管瘤为常染色体显性遗传,估计约占所有脑海绵状血管瘤病例的20%。大多数家族性病例有多发性脑海绵状血管瘤。已知CCM1(KRIT1)、CCM2和CCM3(PDCD10)致病性变异会导致家族性脑海绵状血管瘤。由这3个基因编码的CCM蛋白相互作用,并参与细胞信号通路,包括CCM复合物信号平台的形成。CCM蛋白丢失会导致脑内皮细胞信号通路失调,最终形成病灶。大多数致病性变异是功能丧失性突变,包括无义、移码或剪接位点突变。在某些情况下,可能存在多个外显子或整个基因的缺失或重复。
家族性脑海绵状血管瘤主要与三种基因突变(CCM1、CCM2、CCM3)相关,任一基因的异常都可能导致疾病的发生。如果家庭中有成员患病,则子代有50%的可能性继承此病。正常情况下,人体中的每种基因都有两份拷贝,如果其中一份发生突变,该基因的功能将受到影响。
多发性海绵状血管瘤案例分享:
嘉佳2岁时(2006年)因脑出血确诊多发性海绵状血管瘤(累及额叶、颞叶)。由于肿瘤位置深、涉及重要脑区,手术风险极高,但保守治疗无法阻止病情进展。4岁时(2008年),她在国内医院接受首次切除手术。然而6年后(2014年),肿瘤再次出血,引发抽搐、视力障碍等症状,后续又出现顶叶和基底节出血(2015-2017年),保守治疗效果有限,症状持续加重。
2020年,嘉佳找到INC德国巴特朗菲教授。一次住院3周时间,教授通过高精度神经电生理监测,分两次手术全切基底节和顶枕叶病变,术后无并发症且恢复迅速。
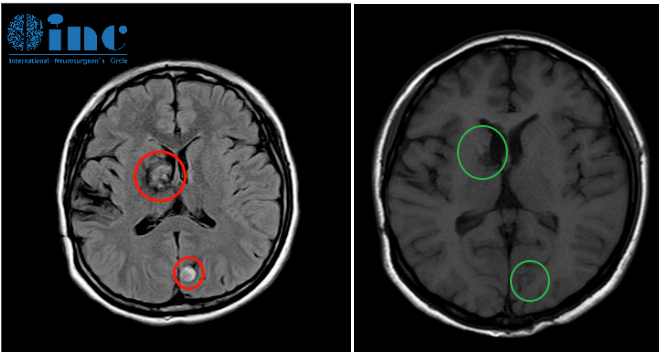
术前术后影像对比(红色术前,绿色术后)
散发性脑海绵状血管瘤
约80%的脑海绵状血管瘤为散发性。大多数散发性表现为孤立性病灶,常伴有发育性静脉畸形,但散发性偶尔表现为发育性静脉畸形周围的多发病灶。
散发性脑海绵状血管瘤是获得性病变。连续MRI已发现新发脑海绵状血管瘤。与获得性散发性脑海绵状血管瘤有关的因素包括:颅脑放疗、遗传易感性。
如何知道是否有脑海绵状血管瘤的基因呢?
基因检测——若患者影像学检查示多发性脑海绵状血管瘤、有脑部放疗史或有脑海绵状血管瘤阳性家族史,则需对CCM1(KRIT1)、CCM2和CCM3(PDCD10)致病性变异进行基因检测。检测应包括直接测序和缺失/重复分析。
对于新发脑海绵状血管瘤病例,医生应在诊断时获取三代家族史,尤其注意有出血性脑卒中、MRI扫描异常、癫痫或其他神经系统并发症史的家族成员。然而,家族性脑海绵状血管瘤不完全外显、表现不一(甚至在家族内),这可能混淆家族史。
脑海绵状血管瘤可以一直观察吗?走向不同命运的他们
如果决定手术治疗,手术时机是一个重要方面。一些患者可能会出现复视等其他症状,由于这些症状和中风很像,所以有时患者被诊断为中风,但这不是缺血性中风,是由内在因素引起的脑干出血。接下来,我们应该做什么,是否应该等待,都需要具体评估。下图这个患者,第一次出血后症状不严重,选择了等待。但是16个月之后,她再次出血,10天内发生了大出血,她几乎昏迷、瘫痪等;在这危急生命的情况下,立即进行手术。巴教授为其手术,手术很成功,脑干在解剖学上也恢复的非常好。
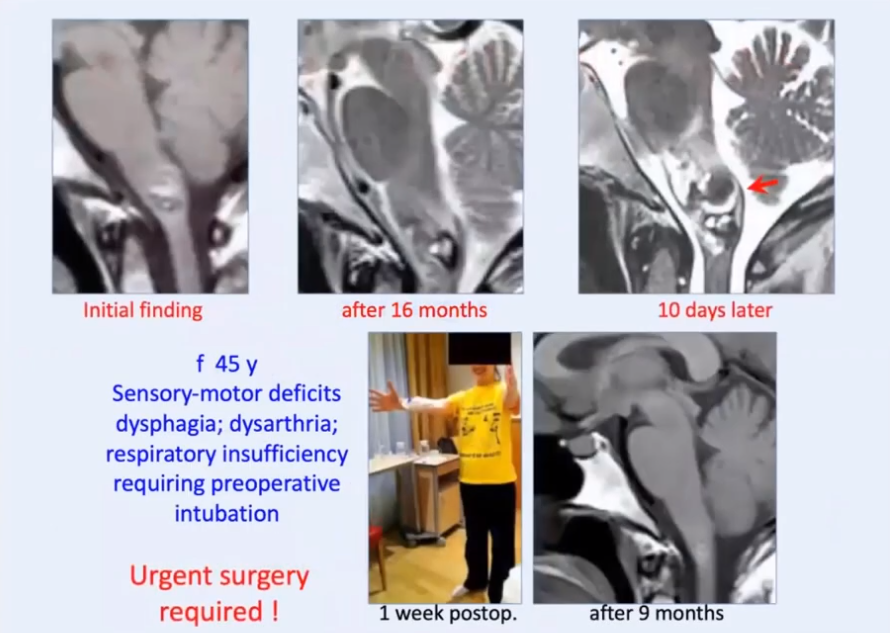
在巴教授示范手术的患者中、许多经历了反复的出血和后遗症影响,经年累月的反复脑干出血导致了视力、肢体运动感觉功能障碍等,可严重影响了工作生活,我们就有患者40年中反复出血,20岁即确诊了脑干海绵状血管瘤,直到60岁才得巴教授手术全切了,只感生命的无常无奈、却也幸也温情眷顾,只可惜要能早30年第一次出血后就手术,生命也许会完全不同。而更为不幸的是,对于反复出血、病史较长,复杂,且经历伽马刀治疗的患者,极有可能发生了肥大性下橄榄核变性(HOD),出现肢体抖动,走路平衡不好的等问题,这些问题甚至可能手术成功后也无法缓解,让患者遭受身体和精神的双重打击。
而值得庆幸的是,随着脑干海绵状血管瘤患者认知的加深,现在越来越多的脑干海绵状血管瘤患者意识到想要争取到好的预后生活质量,第一次出血后就选择手术格外重要。点击阅读:脑干海绵状血管瘤第一次出血后VS反复出血后手术,术后效果真的一样吗?
如果您也有想要分享的经历或者无法解答的疑惑,欢迎留言。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号