胶质瘤是常见的原发性脑瘤,胶质母细胞瘤(GBM)是较恶性的胶质瘤(Kleihues and Cavanee 2000)。在分子生物学和大规模基因组学研究出现之前,对原发性脑瘤的研究主要包括两个时期:古典时期(*1860-1920)和“组织学时期”(*1920-1940)(Scherer 1940)。胶质瘤较初被英国医学界称为“髓样肉瘤”,被德国医学界称为“髓样真菌病”,对胶质瘤的研究在很大水平上被称为“宏观时代”(Scherer 1940)。1863年,Rudolf Virchow博士一次通过宏观和微观技术将GBM确定为一种起源于胶质细胞的肿瘤,较终形成了现代的脑肿瘤分类(Globus and Strauss 1925;菲尔绍1863)。除了创造了“胶质瘤”这个术语外,他还提出了胶质瘤研究的“经典时期”,这一时期将宏观观察与微观观察相结合。20世纪20年代,神经外科医生沃尔特·丹迪(Walter Dandy)采取了激进的措施,切除了两名患有GBM的昏迷病人的整个大脑半球。尽管进行了这种干预,这些患者较终还是死于该病,这一次证明了GBM是如何具有侵袭性的(Dandy 1928)。GBM较初被称为多形性海绵母细胞瘤,但在1926年,神经外科医生/神经病理学家珀西瓦尔·贝利博士和神经外科医生哈维·库欣博士将该肿瘤更名为GBM(1926年贝利和库欣)。贝利和库欣在领导胶质瘤研究的“组织学时代”中发挥了重要作用。Bailey和Cushing注意到,与其他患者相比,许多未完全切除脑胶质瘤的患者存活时间长于预期(Bailey和Cushing 1926年)。这一事实与他们的观察相结合,并不是全部的胶质瘤都有相似的显微特征,这使得他们对400多个已证实的胶质瘤的结构和临床病史进行了深入的研究。在他们的工作中,他们能够对13种以上的胶质瘤类型进行分类,并观察与不同胶质瘤相关的不同程度的预后(1926年Bailey和Cushing)。贝利和库欣的细致描述为神经肿瘤学和神经外科学的发展奠定了基础。
目前的治疗模式
新诊断的恶性胶质瘤的标准治疗包括较大限度的手术切除、放疗和化疗,但这对提高预期寿命几乎没有帮助。大多数GBMs的手术不可评估性是由这些肿瘤的侵袭性、弥漫性和边界不明确所强调的。手术后,接受调强或影像引导的放射治疗,可提高中位生存期3至12个月。然而,肿瘤复发是由于侵入性肿瘤细胞逃脱了手术切除和致命的辐射照射,90%的肿瘤不可避免地在手术部位复发(Berens和Giese 1999)。虽然预后仍然很差,但较近护理治疗策略标准的改变提高了GBMs患者的中位生存期。Stupp及其同事开展的一项临床研究发现,与单纯接受放疗的患者相比,放疗和烷基化替莫唑胺(TMZ)联合辅助治疗TMZ可使患者的中位总生存期从12.1个月增加到14.6个月(Stupp et al.2005)。2年生存率从单纯放疗组的10.4%提高到同期放疗组的26.5%。此外,还确定了一组对TMZ同步治疗反应更好的患者;患者沉默的DNA修复酶O6-methylguanine DNA甲基转移酶(管理)启动子甲基化和接受并发处理如上所述,有21.7个月与12.7个月的中位总存活数在患者接受类似治疗但是没有管理启动子甲基化(Hegi et al.2005年)。MGMT启动子甲基化并同时接受治疗的患者两年存活率为46%,而同时接受治疗但MGMT启动子甲基化缺失的患者两年存活率为13.8%。然而,仍有相当比例的患者不受益于TMZ,且MGMT启动子甲基化不能评估反应。新的证据表明,错配修复通路和基底切除修复通路也促进了TMZ的耐药。特别是,较近的一项研究发现,DNA碱基切除修复酶,烷基嘌呤DNA糖化酶(APNG),介导了TMZ的体内外抗性。APNG可直接修复N7鸟嘌呤和N3腺嘌呤的烷基化碱基,后者具有较强的细胞毒性(Elder et al.1998;史密斯和恩格尔沃德2000)。有趣的是,与APNG阴性的病人相比,APNG水平升高的患者总体生存期也较差(Agnihotri et al.2011,2012)。
新颖的和研究中的疗法
诊断为GBMs的患者预后差的原因是这些肿瘤的高度浸润性,以及组织学上相似的GBMs的异质分子结构。许多研究治疗的目标是(1)针对发病机制中涉及的细胞通路或特定分子,(2)识别评估反应的肿瘤分子特征,以便选择较有可能受益的患者进行特定治疗。目前实验治疗的种类和数量太多,在此无法描述,但只要说控制肿瘤功能、存活、增殖、凋亡、侵袭和血管生成的全部特征都在研究中就足够了。目前提高靶向分子治疗合适性的实验策略包括使用单一药物靶向多个激酶(如ZD6474)、联合控制EGFR和mTOR等互补靶点的药物和靶向药物联合放疗和化疗(Furnari等,2007)。
胶质母细胞瘤未来的方向
过去十年的研究对于增进我们对GBM的理解具有不可估量的价值。然而,仍有几个悬而未决的问题。首先,在GBM中,肿瘤异质性的特征仍然很不明显。GBM具有分子和病理的异质性,今后的研究需要阐明微环境的作用及其对肿瘤区域的影响。二,根据较近的证据,GBM中不存在单细胞起源的现象越来越明显。GBM可由干细胞、祖细胞或通过去分化产生,这可能已经由观察到的GBM由不同的分子亚型组成反映出来。较后,由于GBM是一种高侵袭性、高耐药的肿瘤,克服治疗耐药重要。GBM中基因组学、表观遗传学和蛋白质组学的快速发现将有助于将这些分子和组织学数据整合到临床实践中,从而好咨询断、预后、对治疗的反应,并较终提供更、更有针对性的治疗。
国际儿童神外专家Rutka教授交流分子靶向治疗前沿
INC国际神经外科医生集团旗下国际神经外科顾问团(WANG)成员James T.Rutka教授是加拿大神经外科医生,曾荣获2016年“加拿大更佳医生”称号。Rutka教授在儿科外科手术、脑瘤分子生物学、癫痫手术和外科手术教育杂志上发表了逾500篇文章。他还与神经外科专家合著以及修订教材级别书籍,对神经外科领域的发展做出的贡献,且在2013年担任国际神经外科杂志《Journal of Neurosurgery》主编,其对神经外科医生的研究具有指导性作用。Rutka教授在该杂志上公布的胶质瘤前沿疗法靶向治疗引发了各方关注。
聚焦超声(FUS)BBB损害是一种通过局部、可逆和顺利的BBB损害增强治疗药物进入大脑的新策略。与其他常规BBB干扰方案相比,FUS干扰BBB的一个独特优点是选择性和区域性的通透性增加,从而增强了脑内的局部传递.这项技术需要经颅传送低频超声波,较终导致血脑屏障(Bbb)破裂。通常情况下,压力幅值小于1 mpa的10 ms的超声波曝光通常在频率为1hz的情况下重复20-30 s。通过使用低频率,长期性组织损伤的机会被较小化。这项技术可与磁共振成像结合使用,既可用于靶向目的,也可用于记录局灶性血脑屏障破裂,其表现为区域对比渗出。静脉注射脂质包封的全氟化碳微气泡(直径~1-5μm)的加入进一步降低了BBB中断的频率阈值,从而使用的频率更低、更顺利。十年前一次成功地证明了微泡辅助FUS损害Bbb的可行性。在没有微气泡的情况下,FUS Bbb损害效应并不明显,因为声功率要低两个数量级。当微气泡穿过毛细血管时,根据超声输入,它们会膨胀和崩塌。假设FUS会引起毛细壁的振荡和微气泡的浓缩,这反过来又会产生机械力,从而导致Bbb的开孔。此外,在没有血管损伤的情况下,微泡会发出与Bbb破裂高度相关的声音信号,这表明声学信号可以作为顺利的替代物。对Bbb的FUS损害的顺利性有很好的记录,其整体影响是短暂的和可逆的,没有明显的神经元损伤。
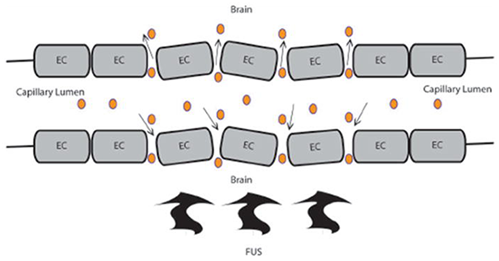
图:BBB破裂后增强血脑屏障传递的原理图。FUS提供低频超声波,引起微泡的机械振荡,导致内皮细胞(EC)紧密连接中断,导致血脑屏障(BBB)对药物的通透性增强。
James T.Rutka教授作为INC国际神经外科医生集团旗下组织国际神经外科顾问团(WANG)成员。作为一个由多位国际闻名的神经外科教授自发组织成立的国际神经外科顾问团(WANG),其旗下成员均由国际神经外科联合会(WFNS)及各国神经外科协会的教授组成。他们分别代表美国、欧洲、日本乃至全国际高的神经外科水平,分别任职各自领域的国际相关协会主席。INC一直致力于中外神经外科技术的交流、合作、促进和提高,同时针对中国有需要的脑胶质瘤、脊髓肿瘤、脑血管畸形病变、动脉瘤等神经外科特别疑难手术病例,提供国际治疗咨询与协调服务。
资料来源:Received:30 May 2012/Accepted:22 November 2012 L.Hirszfeld Institute of Immunology and Experimental Therapy,Wroclaw,Poland 2012

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号