胶质瘤为何影像难看透?
胶质瘤,作为一种常见的原发性脑肿瘤,其恶性程度差异极大,从低级别到高级别不等,仅凭MRI难以百分百确诊。虽然多数肿瘤可以根据MRI判断良恶性,但手术后取得肿瘤组织,进行病理检查才是诊断肿瘤级别的“金标准”。临床中常根据颅脑磁共振初步诊断,可以反映病变的位置、形态、生长特点及与关键神经组织的关系。
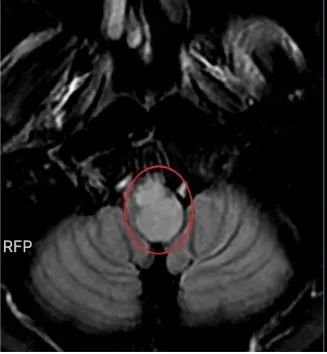
张先生因头晕、呕吐等症状就医,经检查发现脑干延髓存在占位性病变。初步影像评估曾让医生怀疑为低级别胶质瘤,然而,这一初步判断背后隐藏着巨大的不确定性。张先生的案例尤为典型,他的肿瘤不仅位置特殊,位于脑干延髓这一生命中枢,而且成长形态复杂,手术难度极高。
面对这样的困境,不手术意味着肿瘤可能持续生长,对脑干造成不可逆的压迫,进而引发瘫痪、呼吸障碍,甚至危及生命;而手术,则是对未知肿瘤性质的勇敢挑战,因为若肿瘤并非预期的低级别,其发展速度可能远超预期。
因此,对于张先生而言,尽早手术切除肿瘤以减小体积,并在术后迅速明确肿瘤病理类型,成为了治疗过程中的两大核心目标。与许多低级别胶质瘤患者倾向于保守观察的态度不同,张先生选择了更为积极的手术,他渴望尽快解决眼前的健康危机。
手术的成功实施,本应是希望的曙光,但病理结果的揭晓却带来了沉重的打击——张先生被确诊为恶性四级弥漫中线胶质瘤,这是胶质瘤中最为凶险的一种类型。影像判断与病理真相可能天差地别,也警示在面对这类肿瘤时,时间就是生命,早期干预不仅能争取确诊时机,更能为后续治疗创造宝贵机会。每一次犹豫都可能付出不可挽回的代价,而果断的治疗决策往往能改写结局。
脑MRI可以判断胶质瘤良恶性吗?症状轻一定是低级别吗?
症状轻≠低级别
胶质瘤的隐匿性往往让人防不胜防。看似温和的良性肿瘤可能悄无声息地生长,而凶险的恶性肿瘤却可能在短时间内引发剧烈头痛、癫痫发作等危急症状。但最令人担忧的是,由于大脑具有惊人的代偿能力,即便肿瘤在不断进展,患者也可能长期没有任何不适。这种"无症状期"往往给人造成虚假的安全感,导致许多患者错过了最佳治疗时机。
当因早期无症状而忽视治疗,直到出现头痛、复视、步态不稳等压迫症状,甚至因脑干受压导致昏迷或生命危险,才惊觉病情已至危局。一旦错失早期干预的“黄金窗口期”,肿瘤体积增大、级别升高,治疗难度将成倍增加——症状越重,手术风险越高,术后功能恢复也越困难。
影像如何判断良恶性?

直接征象:观察病变的特点,包括病灶的形态、信号特点及边缘情况,肿瘤内有无囊变、坏死、出血、钙化等,这些征象是确定肿瘤类型和良、恶性程度的重要依据。
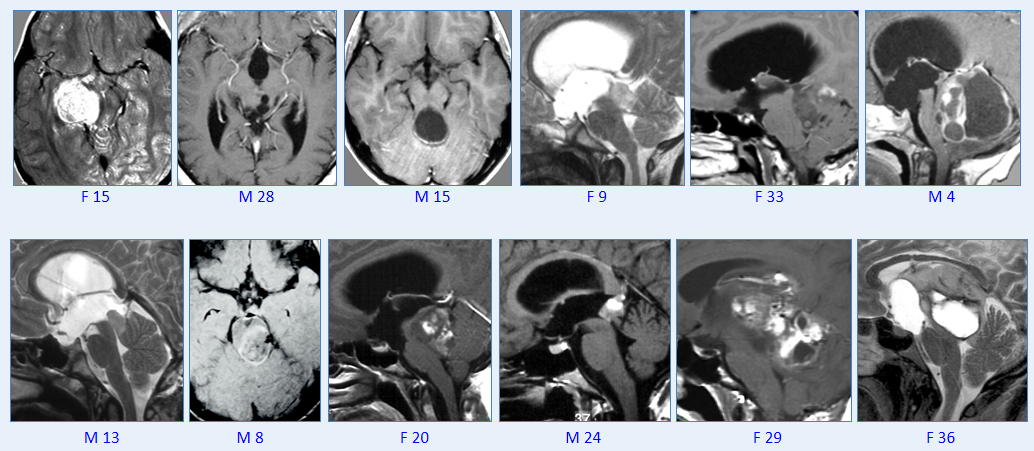
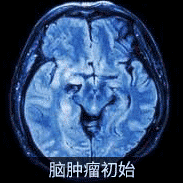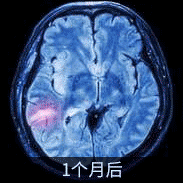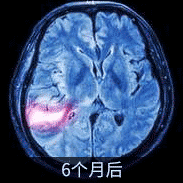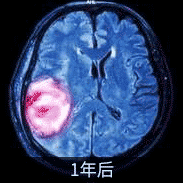
INC巴教授部分毛星案例影像
强化表现:增强扫描反映的是血脑屏障是否存在或完整,病变的强化程度与血供及血脑屏障密切相关。低级别胶质瘤血脑屏障功能接近正常(不强化),高级别胶质瘤血脑屏障功能缺乏(强化、肿瘤破坏血管导致血脑屏障形成异常以及肿瘤新生血管),大多数胶质瘤的恶性程度越高,其血脑屏障受损越重,强化就越明显。
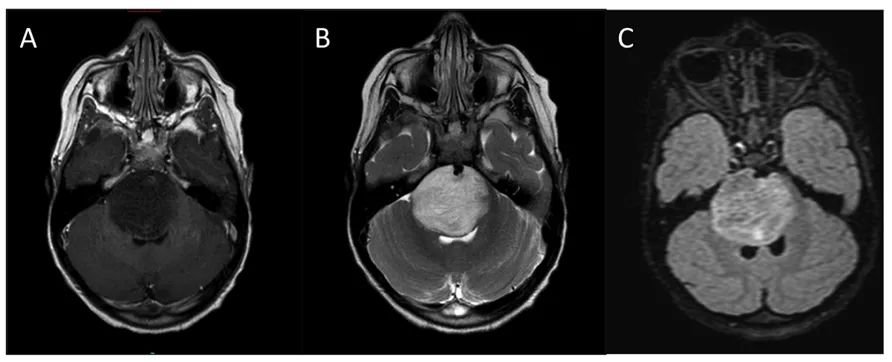
DIPG患者影像
病理诊断才是金标准
手术活检病理是胶质瘤确诊的“金标准”,近年来,病理学诊断也从 H&E 染色发展到免疫组化染色。根据显微镜下脑肿瘤的异常外观,病理医师会基于胶质瘤的恶性或致癌程度对肿瘤进行 1-4 个级别的划分。
世界卫生组织(WHO)中枢神经系统肿瘤分类是神经肿瘤临床诊断和治疗的重要依据,经过四十余年发展,逐步由以组织学为基础的分类系统更新到2021年的(WHO CNS5)新分类,提出由组织学、生物学和分子特征共同定义肿瘤类型,突出分子病理的作用。
新版分类中,病理分级仍然使用1-4级分型,总结关键几点如下:
1. 病理分类分级中不再有“间变性或间变型”类型
2. 胶质母细胞瘤GBM仅用于指成人IDH-野生型类型肿瘤
3. WHO Grade 4四级包括如下分子基因突变特点:IDH野生型GBM,H3K27突变型弥漫性中线胶质瘤DMG,H3 G34突变型半球胶质瘤DHG,IDH野生型、H3野生型儿童高级别胶质瘤。
根据世界卫生组织(WHO)的分类标准,被划分为 1-2 级的神经胶质瘤被定义为低级别,因为它们的细胞分化良好,侵袭倾向较低,且有更好的预后;3-4 级的神经胶质瘤则被定义为高级别,通常它们的细胞未分化,且高度恶化,预后较差。一个肿瘤或许含有不同分级的细胞,但是医生会以恶化级别较高的细胞作为分类基准。
· 1级胶质瘤:往往与长期的生存期有关,在儿童中较常见。在显微镜的观察下,1级胶质瘤生长缓慢,其外观近乎正常。在手术后,往往无需额外的治疗。较为常见的是毛细胞型星形细胞瘤,手术全切后可达到治愈标准,中位生存期可长达数十年;
· 2级胶质瘤:生长相对缓慢,其中一部分可以扩散到邻近的正常组织中,亦可转化为一个分级更高的肿瘤。在手术后可能需要额外的治疗。较为常见的是少突胶质细胞瘤,其5年生存率为40-80%,中位生存期3-5年;
· 3级胶质瘤:该肿瘤会繁殖侵袭周围组织的异常细胞,具有循环往复的倾向。在手术后往往需要额外的治疗,特别是放射疗法和化学疗法。3级胶质瘤包括间变性星形细胞瘤,间变性室管膜瘤,间变性少突胶质细胞瘤和间变性少星形胶质瘤,5年生存率为30-60%,中位生存期2-4年;
· 4级胶质瘤:恶性程度高且极具侵袭性的脑肿瘤。在显微镜观察下,它们的细胞极其异常,它们会征集新的血管以维持自身快速的生长。通常为GBM(胶质母细胞瘤),5年生存率小于10%,中位生存期12-14个月。
(注:不同的研究,结果可能会有轻微浮动)
近年来,神经肿瘤分子病理取得了重大进展,目前已发现一系列有助于脑胶质瘤临床诊断和预后判断的分子标志物。这些新近发现的分子变异有可能成为未来治疗的新靶点,有望揭开脑胶质瘤病理生理和发病机制的神秘面纱。除了种族、性别、年龄、生活习惯等常见因素,重要分子标志物的筛选对临床胶质瘤进一步病理分型的诊断、治疗及预后判断等具有重大的意义。
治疗原则
手术是绝大多数脑胶质瘤的首选治疗方式,也是生存质量和生存期的保证。手术的目的有两个:在保留神经功能的前提下尽可能多的切除肿瘤;获得准确的肿瘤病理诊断分级。
对于低级别的良性胶质瘤,手术全切带来的好处更多,⽣存期也会更长⼀些。有些WHO 1级的胶质瘤可以通过全切⽽治愈。低级别的放化疗目前仍有争议,需要根据不同危险因素采取不同的治疗策略方案。
对于高级别的恶性胶质瘤,一般治疗原则为在不损伤神经的前提下,尽可能多地切除强化的病灶,通常可缓解术前症状;明确病理诊断,为辅助放/化疗创造条件;延长术后复发时间和生存期,提高生存质量。
由于神经系统的解剖生理特点,胶质瘤开颅手术有其自身的特殊性。外科医生必须熟悉中枢神经系统的解剖、生理功能特点,进而选择针对患者的理想手术入路,并能对病变进行有效处理。
此外,术前手术设计和术中操作应尽可能地保护重要结构不受损害,术中操作必须谨慎、细致,可借助术中磁共振(iMRI)、术中神经导航以及术中神经电生理监测等设备,尽可能地保护正常的神经组织。因此,对于胶质瘤患者,尤其是像脑干这种复杂位置的胶质瘤患者,主刀医生的手术经验和技术尤为重要。
因本身病理、放疗或不规范治疗等因素,部分的良性胶质瘤也可能恶化升级为恶性胶质瘤。胶质瘤,包括很多脑肿瘤的治疗实际上是个与时间赛跑的过程,脑肿瘤会快速或缓慢进展,其恶化或转移所给患者带来的都可能就是无法承受的严重后果。早期手术是对抗胶质瘤的良好时机。
INC国际教授胶质瘤案例
◉ “谢谢巴爷爷给我治疗”——母子连心战胜脑干胶质瘤,全家人的开心果又回来啦!
◉ 10岁男孩开颅术后竟无需进ICU——这个位置0.1毫米失误都不可以!
◉ 打败脑干胶质瘤的学霸少年!术后近4年无复发,学业更上一层楼
◉ 破脑干“禁区”!32岁周老师述谢谢你让我的生命葱葱郁郁、山花烂漫!
◉ 延髓-颈髓手术风险太大!一旦术中呼吸骤停,没有存活可能?
◉ 专访 | 胶质瘤DNET少年归来:“再千难万险都必须找巴教授!”
◉ 全切肿瘤+保功能两者真不可兼得吗?六旬功能区胶质瘤老人交出完美答卷

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号