
INC国际神经外科医生集团旗下世界神经外科顾问团(WANG)成员、世界神经外科联合会(WFNS)颅底手术委员会前主席Sebastien Froelich教授(塞巴斯蒂安·福洛里希,“福教授”)多年来专注于颅底肿瘤的学术研究和临床实践。脑膜瘤是他的主要研究领域之一。
在接受INC专访时,他表示:“我的主要研究方向是女性患者出于多种原因使用的黄体酮治疗与脑膜瘤之间的关系。它们之间存在密切的联系,有时候仅仅是停止使用该药物,就能无需手术治疗。因为这种药物可能会促进某些脑膜瘤的生长,甚至加速它们的复发。”

正如福教授所述,他对于醋酸环丙孕酮(CA)与脑膜瘤之间的关联进行了深入研究,并且围绕该课题发表了众多学术论文。
虽然脑膜瘤大多为良性肿瘤,生长较为缓慢,且手术或放疗的必要性相对较低,但它依然是一种有可能导致颅内损害的病变。
上世纪90年代,科研人员成功研发了一种预防流产的孕激素类药物。在实验过程中,一个意外的发现引起了他们的注意:服用该药物的怀孕大鼠所生的后代几乎全部为雌性。但进一步的染色体检测揭示了一个惊人的事实——其中约半数幼崽在遗传学上其实是雄性。由此表明该孕激素药物具备抗雄激素的特性。
该药物即为醋酸环丙孕酮。它属于第一代孕激素类药物,并且是较早用于医疗目的的抗雄激素药物。在全球多数国家,它得到了广泛的应用,既可作为避孕药的一种成分,也可治疗与高雄激素水平相关的疾病,如痤疮、多毛症、性早熟和前列腺癌,此外,还用于跨性别女性的激素治疗。
自2007年起,就有病例报告指出长期服用高剂量(每日25-100毫克)醋酸环丙孕酮与脑膜瘤的发生有关。不同剂量(10毫克、50毫克和100毫克)的醋酸环丙孕酮药品分别于2009年、2011年和2013年更新了使用说明书,以警示长期使用该药物的患者可能发生的脑膜瘤风险。
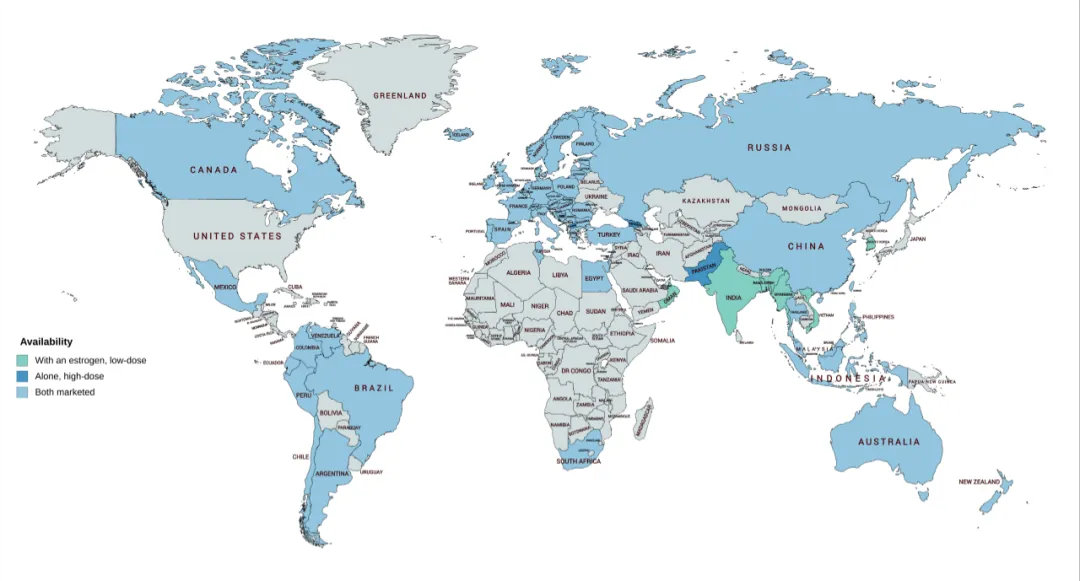
全球范围内醋酸环丙孕酮的应用状况如下:绿色区域表示可以与低剂量雌激素联合使用,深蓝色区域表示可以单独使用高剂量,而浅蓝色区域则表示既可以单独使用高剂量也可以与低剂量雌激素联合使用。
病例:停止服用CA后脑膜瘤体积减小
该案例出自福教授所发表的学术论文,其中呈现了醋酸环丙孕酮(CA)与脑膜瘤治疗之间的相关案例,验证了二者之间的联系。

福教授发布于《Journal of Ophthalmic and Vision Research》上的论文:《Regression of Giant Olfactory Groove Meningioma and Complete Visual Acuity Recovery after Discontinuation of Cyproterone Acetate》(案例报告:在停用醋酸环丙孕酮后巨型嗅沟脑膜瘤的消退和视力的完全恢复)
这是一位65岁的女性病患,她在过往持续接受醋酸环丙孕酮(CA)的治疗。
在过去一年里,她逐渐感到疲乏、注意力下降,并且出现了视力问题。经过一系列医疗检查,结果显示,她的脑内长有一个巨大的嗅沟脑膜瘤,伴随视交叉症。幸运的是,她的眼科检查并未显示出异常。因此,医生决定对她通过密集的成像和眼科监测来延长她观察期,且建议她停止使用醋酸环丙孕酮。
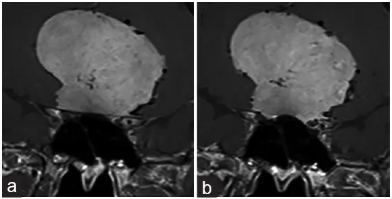
该患者停止服药前的磁共振成像(MRI)影像,显示了视神经与脑膜瘤之间的位置关系。
在停用CA治疗后的第5个月和第18个月,患者分别进行了医疗随访。在第二次随访中,通过MRI检查发现,她的脑膜瘤体积显著地持续性缩小,由最初的69平方厘米下降至35平方厘米。
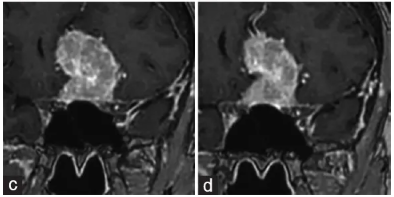
该患者停止服药后的磁共振成像(MRI)影像
论文分享:长期服用大剂量CA与女性罹患脑膜瘤的风险率
在另一篇论文中,福教授则与其他研究人员一同开展了一起大型队列研究,进一步探索了长期摄入高剂量的醋酸环丙孕酮与女性罹患脑膜瘤的风险率之间的关系。

该研究结果出自福教授发布于《Bmj-british Medical Journal 》上的论文:《Use of high dose cyproterone acetate and risk of intracranial meningioma in women: cohort study》(高剂量醋酸环丙孕酮使用与女性颅内脑膜瘤风险:队列研究)
该研究在法国开展,使用了法国行政医疗保健数据库(SNDS)的数据。其主要研究对象为2007年至2014年间开始服用高剂量醋酸环丙孕酮的女性群体(年龄范围7至70岁),持续跟踪至2015年年底。
研究中将高剂量定义为前六个月内累积服用量达到或超过3克,而将服用量低于3克的群体作为低剂量的对照组。研究中共有253.777名参与者,其中54.9%(即139.222名)被分配到大剂量组,剩余的114.555名参与者构成了对照组。
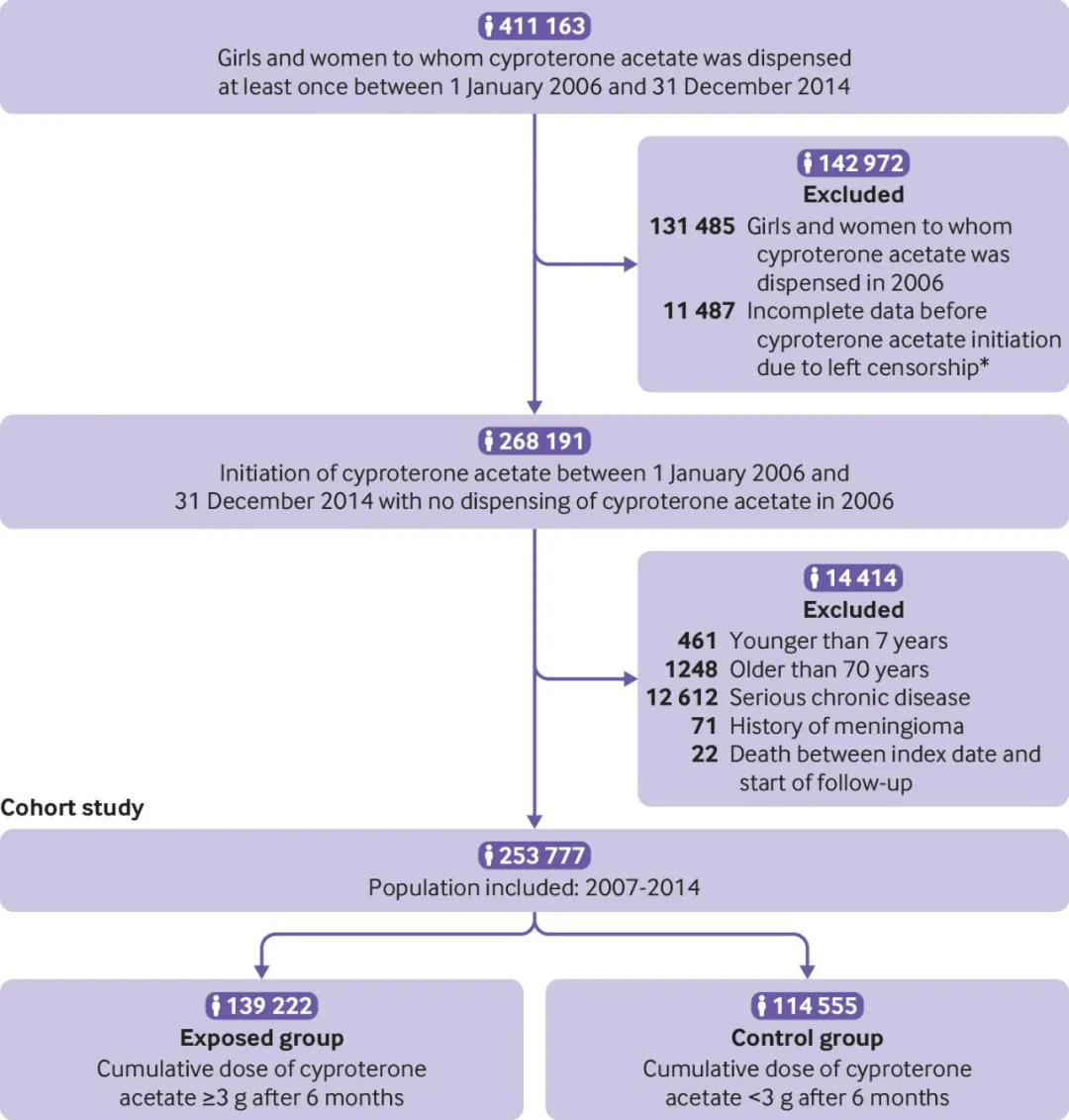
研究筛选流程示意图
在高剂量组中,记录到69例需要手术或放疗的脑膜瘤病例,相比之下,对照组仅有20例。两组的发病率分别为每10万人年23.8例和每10万人年4.5例。在校正了多种影响因素后,结论为高剂量组患脑膜瘤的风险相较于对照组提高了5.6倍。
通过对累积剂量进行分析,结果显示出明显的剂量效应。在累积剂量12克以下的高剂量组中,并未观察到显著的风险增加。然而,当累积剂量超过30克时,风险迅速上升。在30-60克的亚组中,风险增加了10.3倍;而在60克及以上的亚组中,风险增加了20.7倍。
幸运的是,停药后这种增加的风险会逐渐降低。停药一年后,高剂量组患脑膜瘤的风险降至对照组的1.8倍,而对于累积剂量达到12克及以上的患者,风险则降至4.2倍。
研究团队还对队列中服用醋酸环丙孕酮的跨性别女性进行了研究。在高剂量组中,有3名跨性别女性发生脑膜瘤,其发病率为每10万人年20.7例,而在对照组中并未有脑膜瘤病例报告。然而,这一发现在跨性别女性中并未达到统计学上的显著性(p=0.08),并且这3名患者的日剂量在100-150毫克之间,属于较高的剂量水平。
在2006年就开始使用醋酸环丙孕酮的女性补充群体(共123.997人)中,按照相同标准划分的高剂量组中服用雌激素的比例也较高(55.5% 对比 31.9%)。高剂量组中脑膜瘤的发病率达到每10万人年141例(共447人),与对照组相比,风险增加了20.2倍。
在上述两个队列中,所有服用醋酸环丙孕酮并发展为脑膜瘤的患者中,有96%的患者接受了手术治疗,而4%的患者接受了放疗,其中大多数患者的年龄超过45岁(占比60.5%)。
高剂量组和对照组患者在脑膜瘤的发生位置上存在显著差异。在高剂量组中,常见的脑膜瘤位置是前颅底和中颅底,特别是前颅底,高剂量组发生前颅底脑膜瘤的风险增加了47倍。
这些数据表明,在女性中,高剂量醋酸环丙孕酮的使用与脑膜瘤风险的显著上升相关,并且这种风险随着剂量的累积而增加。而在停药后,这种增加的风险将会降低。
黄体酮与脑膜瘤的发病和生长密切相关,其作用机制可能包括激素受体介导的细胞增殖、信号通路激活和免疫环境调节等方面。针对这一关联,需要更深入的研究来优化治疗和预防策略。
黄体酮与脑膜瘤发病的作用机制
1、激素受体介导
1)脑膜瘤中的孕激素受体表达:研究发现,大约70%-80%的脑膜瘤表达孕激素受体(PR)。黄体酮通过与脑膜瘤细胞中的孕激素受体结合,可能促进细胞增殖和肿瘤生长。
2)与雌激素的协同作用:部分脑膜瘤同时表达雌激素受体(ER)。孕激素可能通过与雌激素受体的协同作用进一步加速脑膜瘤的生长。
2、细胞信号通路激活
1)PI3K/AKT/mTOR通路:孕激素可能通过激活PI3K/AKT/mTOR信号通路,增强脑膜瘤细胞的存活和增殖能力。
2)VEGF相关血管生成:孕激素可能促进血管内皮生长因子(VEGF)的分泌,增加肿瘤血管生成,为脑膜瘤的生长提供支持。
3、炎症和免疫环境变化
孕激素可能通过调节免疫微环境,减少免疫系统对脑膜瘤细胞的识别和清除,从而促进肿瘤生长。
4、遗传和表观遗传机制
长期孕激素暴露可能通过影响基因表达和DNA甲基化状态,促进脑膜瘤相关基因(如NF2基因)突变或异常表达。
临床意义
风险评估:对于有脑膜瘤家族史或其他高风险因素的患者,应谨慎评估使用黄体酮类药物的风险。
诊断和治疗:对于孕激素受体阳性的脑膜瘤,可能需要重新评估激素治疗的必要性。而针对激素受体的靶向治疗,如抗孕激素药物(如米非司酮),可能成为治疗的一部分。
预防措施
避免长期或高剂量使用黄体酮类药物,特别是绝经期女性和有脑膜瘤风险的患者。
在治疗脑膜瘤时,可以考虑检测肿瘤的孕激素受体状态,以指导个性化治疗策略。
脑膜瘤在女性中的发病率较高,女性与男性的比例大约为2:1或3:1.一些研究提供了证据,表明激素因素可能在脑膜瘤的形成中扮演了一定的角色。特别是在孕期,女性体内分泌的高剂量具有抗雄激素作用的环丙孕酮,随着累积剂量的增加,可能会小幅提高脑膜瘤的风险。
而在脑膜瘤的几种常见治疗方案中,手术是一种根本性的治疗方式。然而,脑膜瘤所在位置往往涉及到复杂的神经系统结构,手术风险相对较高,需要精确的操作和丰富的临床经验。此外,肿瘤的切除程度对患者的预后有着重要影响。因此,在考虑采取手术治疗脑膜瘤的过程中,选择一位经验丰富的神经外科医生显得尤为关键。

 胶质瘤
胶质瘤 垂体瘤
垂体瘤 脑膜瘤
脑膜瘤 脑血管瘤
脑血管瘤 听神经瘤
听神经瘤 脊索瘤
脊索瘤




 沪公网安备31010902002694号
沪公网安备31010902002694号